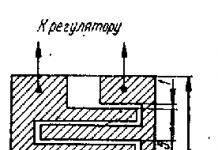
Чистое вещество содержит частицы только одного вида. Примерами могут служить серебро (содержит только атомы серебра), серная кислота и оксид углерода (IV) (содержат только молекулы соответствующих веществ). Все чистые вещества имеют постоянные физические свойства, например, температуру плавления (Т пл) и температуру кипения (Т кип).
Вещество не является чистым, если содержит какое-либо количество одного или нескольких других веществ – примесей .
Загрязнения понижают температуру замерзания и повышают температуру кипения чистой жидкости. Например, если в воду добавить соль, температура замерзания раствора понизится.
Смеси состоят из двух или более веществ. Почва, морская вода, воздух – все это примеры различных смесей. Многие смеси могут быть разделены на составные части – компоненты – на основании различия их физических свойств.
Различают гомогенные (однородные) и гетерогенные (неоднородные) смеси. Особенностью гомогенной смеси является то, что между компонентами такой смеси не наблюдается поверхности раздела. В этом случае говорят, что данная смесь является однофазной (фаза часть системы отделенная от других частей видимой поверхностью раздела). В пределах одной фазы физические свойства компонентов сохраняются постоянными. К гомогенным системам относятся истинные растворы (размер частиц растворенного вещества соотносится с размерами частиц растворителя и составляет ≤10 -9 м).
Особенностью гетерогенной смеси является то, что мы можем наблюдать поверхность раздела между ее компонентами. При переходе из одной фазы компонента в другую его свойства резко изменяются. Гетерогенные смеси иначе называются дисперсные системы. Дисперсные системы состоят из дисперсионной среды (растворитель, непрерывная фаза) и дисперсной фазы (растворенного вещества или прерывистой фазы)
К гетерогенным смесям относятся дисперсные системы (размер частиц растворенного вещества значительно превышает размер частиц растворителя и составляет ≥10 -9 м). Смеси, в которых размер частиц вещества составляет 10 -7 -10 -9 м, относятся к коллоидным системам.
К дисперсным системам относятся:
Суспензии, смесь, состоящая из твердой и жидкой фазы (обозначение Т/Ж; Т- дисперсная фаза, Ж – дисперсионная среда)
Эмульсии, смесь из 2-х и более несмешивающихся жидкостей (обозначение – Ж/Ж. Дисперсная фаза и дисперсионная среда жидкости различающиеся по плотности и температурам кипения).
Более подробно данные системы будут рассмотрены в теме растворы и дисперсные системы.
1.5. Методы разделения смесей
Традиционными методами, которые используются в лабораторной практике с целью разделения смесей на отдельные компоненты, являются:
фильтрование,
декантация (в химической лабораторной практике и химической технологии механическое отделение твёрдой фазы дисперсной системы (суспензии) от жидкой путём сливания раствора с осадка),
разделение с помощью делительной воронки,
центрифугирование,
выпаривание,
кристаллизация,
перегонка (в том числе фракционная перегонка),
хроматография,
возгонка и другие.
Фильтрование. Для отделения жидкостей от взвешенных в ней мелких твердых частиц применяют фильтрование (рис.37) , т.е. процеживание жидкости через мелкопористые материалы – фильтры , которые пропускают жидкость и задерживают на своей поверхности твердые частицы. Жидкость, прошедшая через фильтр и освобожденная от находившихся в ней твердых примесей, называется фильтратом .
В лабораторной практике часто применяют гладкие и складчатые бумажные фильтры (рис.38) , сделанные из непроклеенной фильтровальной бумаги.
Для фильтрования горячих растворов (например, с целью перекристаллизации солей), применяют специальную воронку для горячего фильтрования (рис.39) с электрическим или водяным обогревом).
Часто применяют фильтрование под вакуумом . Фильтрование под вакуумом используют для ускорения фильтрования и более полного освобождения твердой фазы от жидкой. Для этой цели собирают прибор для фильтрования под вакуумом (рис.40) . Он состоит из колбы Бунзена, фарфоровой воронки Бюхнера, предохранительной склянки и вакуум-насоса (обычно водоструйного).
В случае фильтрования суспензии малорастворимой соли кристаллы последней могут быть промыты дистиллированной водой на воронке Бюхнера для удаления с их поверхности исходного раствора. Для этой цели используют промывалку (рис.41) .
Декантация . Жидкости могут быть отделены от нерастворимых твердых частиц декантацией (рис.42) . Этот метод можно применять, если твердое вещество имеет большую плотность, чем жидкость. Например, если речной песок добавить в стакан с водой, то при отстаивании он осядет на дно стакана, потому что плотность песка больше, чем воды. Тогда вода может быть отделена от песка просто сливанием. Такой метод отстаивания и последующего сливания фильтрата и называется декантацией.
Центрифугирование. Для ускорения процесса отделения очень мелких частиц, образующих в жидкости устойчивые суспензии или эмульсии, используют метод центрифугирования. Этим методом можно разделить смеси жидких и твердых веществ, различающихся по плотности. Разделение проводится в ручных или электрических центрифугах (рис.43) .
Разделение двух несмешивающихся жидкостей, имеющих различную плотность и не образующих устойчивых эмульсий, можно осуществить с помощью делительной воронки (рис.44) . Так можно разделить, например, смесь бензола и воды. Слой бензола (плотность = 0,879 г/см 3) располагается над слоем воды, которая имеет большую плотность ( = 1,0 г/см 3). Открыв кран делительной воронки, можно аккуратно слить нижний слой и отделить одну жидкость от другой.
Выпаривание (рис.45) – этот метод предусматривает удаление растворителя, например, воды из раствора в процессе нагревания его в выпарительной фарфоровой чашке. При этом выпариваемая жидкость удаляется, а растворенное вещество остается в выпарительной чашке.
Кристаллизация – это процесс выделения кристаллов твердого вещества при охлаждении раствора, например, после его упаривания. Следует иметь в виду, что при медленном охлаждении раствора образуются крупные кристаллы. При быстром охлаждении (например, при охлаждении проточной водой) образуются мелкие кристаллы.
Перегонка - метод очистки вещества основанный на испарении жидкости при нагревании с последующей конденсацией образовавшихся паров. Очистка воды от растворенных в ней солей (или других веществ, например, красящих) перегонкой называется дистилляцией , а сама очищенная вода – дистиллированной.
Фракционная перегонка (дистилляция) (рис.46) применяется для разделения смесей жидкостей с различными температурами кипения. Жидкость с меньшей температурой кипения закипает быстрее и раньше проходит через фракционную колонку (или дефлегматор ). Когда эта жидкость достигает верха фракционной колонки, то попадает в холодильник , охлаждается водой и через аллонж собирается в приемник (колбу или пробирку).
Фракционной перегонкой можно разделить, например, смесь этанола и воды. Температура кипения этанола 78 0 С, а воды 100 0 С. Этанол испаряется легче и первым попадает через холодильник в приемник.
Возгонка – метод применяется для очистки веществ, способных при нагревании переходить из твердого состояния в газообразное, минуя жидкое состояние. Далее пары очищаемого вещества конденсируются, а примеси, не способные возгоняться, отделяются.
Тип урока. Изучение нового материала.
Цели урока. Обучающие – изучить понятия «чистое вещество» и «смесь», однородные (гомогенные) и неоднородные (гетерогенные) смеси, рассмотреть способы разделения смесей, научить учащихся разделять смеси на компоненты.
Развивающие – развить интеллектуальные и познавательные умения учащихся: выделять существенные признаки и свойства, устанавливать причинно-следственные связи, классифицировать, анализировать, делать выводы, выполнять опыты, наблюдать, оформлять наблюдения в виде таблиц, схем.
Воспитательные – содействовать воспитанию у учащихся организованности, аккуратности при проведении эксперимента, умения организовывать взаимопомощь при работе в парах, духа соревновательности при выполнении упражнений.
Методы обучения. Методы организации учебно-познавательной деятельности – словесные (эвристическая беседа), наглядные (таблицы, рисунки, демонстрации опытов), практические (лабораторные работы, выполнение упражнений).
Методы стимулирования интереса к учению – познавательные игры, учебные дискуссии.
Методы контроля – устный контроль, письменный контроль, экспериментальный контроль.
Оборудование и реактивы. На столах учащихся – листы бумаги, ложечки для веществ, стеклянные палочки, стаканы с водой, магниты, порошки серы и железа.
На столе учителя – ложечки, пробирки, держатель для пробирок, спиртовка, магнит, вода, химические стаканы, штатив с кольцом, штатив с лапкой, воронка, стеклянные палочки, фильтры, фарфоровая чашка, делительная воронка, пробирка с газоотводной трубкой, пробирка-приемник, «стакан-холодильник» с водой, лента фильтровальной бумаги (2х10 см), красные чернила, колба, сито, порошки железа и серы в массовом отношении 7: 4, речной песок, поваренная соль, растительное масло, раствор медного купороса, манная, гречневая крупы.
ХОД УРОКА
Организационный момент
Отметить отсутствующих, объяснить цели урока и познакомить учащихся с его планом.
П л а н у р о к а
1. Чистые вещества и смеси. Отличительные особенности.
2. Однородные и неоднородные смеси.
3. Способы разделения смесей.
Беседа по теме «Вещества и их свойства»
Учитель. Вспомните, что изучает химия .
Ученик. Вещества, свойства веществ, изменения, происходящие с веществами, т.е. превращения веществ.
Учитель. Что называется веществом?
Ученик. Вещество – это то, из чего состоит физическое тело.
Учитель. Вы знаете, что вещества бывают простыми и сложными. Какие вещества называются простыми, а какие – сложными?
Ученик. Простые вещества состоят из атомов одного химического элемента, сложные – из атомов различных химических элементов .
Учитель. Какие физические свойства имеют вещества?
Ученик. Агрегатное состояние, температуры плавления, кипения, электро- и теплопроводность, растворимость в воде и др .
Объяснение нового материала
Чистые вещества и смеси.
Отличительные особенности
Учитель. Постоянные физические свойства имеют только чистые вещества. Только чистая дистиллированная вода имеет t пл = 0 °С, t кип = 100 °С, не имеет вкуса. Морская вода замерзает при более низкой, а закипает при более высокой температуре, вкус у нее горько-соленый. Вода Черного моря замерзает при более низкой, а закипает при более высокой температуре, чем вода Балтийского моря. Почему? Дело в том, что в морской воде содержатся другие вещества, например растворенные соли, т.е. она представляет собой смесь различных веществ, состав которой меняется в широких пределах, свойства же смеси не являются постоянными. Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем: «Смесь – целостная система, состоящая из разнородных компонентов».
Рассмотрим отличительные особенности смеси и чистого вещества. Для этого проделаем следующие опыты.
Опыт 1. Используя инструкцию к опыту, изучите существенные физические свойства порошков железа и серы, приготовьте смесь этих порошков и определите, сохраняют ли эти вещества свои свойства в смеси.
Обсуждение с учащимися результатов проведенного опыта.
Учитель. Опишите агрегатное состояние и цвет серы.
Ученик. Сера – твердое вещество желтого цвета.
Учитель. Каковы агрегатное состояние и цвет железа в виде порошка?
Ученик. Железо – твердое серое вещество .
Учитель. Как эти вещества относятся: а) к магниту; б) к воде?
Ученик. Железо притягивается магнитом, а сера – нет; в воде порошок железа тонет, т.к. железо тяжелее воды, а порошок серы всплывает на поверхность воды, т. к. не смачивается водой.
Учитель. Что можно сказать о соотношении железа и серы в смеси?
Ученик. Соотношение железа и серы в смеси может быть различным, т.е. непостоянным.
Учитель. Сохраняются ли свойства железа и серы в смеси?
Ученик. Да, свойства каждого вещества в смеси сохраняются .
Учитель. Как можно разделить смесь серы и железа?
Ученик. Это можно сделать физическими методами: магнитом или водой.
Учитель. Опыт 2. Сейчас я покажу реакцию взаимодействия серы и железа. Ваша задача внимательно наблюдать этот опыт и определить, сохраняют ли свои свойства железо и сера в полученном в результате реакции сульфиде железа(II) и можно ли выделить из него железо и серу физическими методами.
Я тщательно перемешиваю порошки железа и серы в массовом отношении 7: 4:
m(Fе) : m( S) = А r ( Fе) : А r ( S) = 56: 32 = 7: 4,
помещаю смесь в пробирку, прогреваю в пламени спиртовки, сильно накаливаю в одном месте и прекращаю нагревание, когда начинается бурная экзотермическая реакция. После остывания пробирки осторожно разбиваю ее, предварительно завернув в полотенце, и извлекаю содержимое. Внимательно посмотрите на полученное вещество – сульфид железа(II). Видны ли в нем отдельно серый порошок железа и желтый - серы?
Ученик. Нет, полученное вещество имеет темно-серый цвет.
Учитель. Затем испытываю полученное вещество магнитом. Разделяются ли железо и сера?
Ученик. Нет, полученное вещество не намагничивается .
Учитель. Помещаю сульфид железа(II) в воду. Что вы наблюдаете при этом?
Ученик. Сульфид железа(II) тонет в воде .
Учитель. Сохраняют ли сера и железо свои свойства, входя в состав сульфида железа(II)?
Ученик. Нет, новое вещество обладает свойствами, отличными от свойств взятых для реакции веществ.
Учитель. Можно ли разделить сульфид железа(II) физическими методами на простые вещества?
Ученик. Нет, ни магнит, ни вода не могут разделить сульфид железа(II) на железо и серу.
Учитель. Происходит ли изменение энергии при образовании химического вещества?
Ученик. Да, например, при взаимодействии железа и серы энергия выделяется.
Учитель. Занесем результаты обсуждения опытов в таблицу.
Таблица
Сравнительная характеристика смеси и чистого вещества
Для закрепления этой части урока выполните упражнение: определите, где на рисунке (см. с. 34) изображено простое вещество, сложное вещество или смесь.
Однородные и неоднородные смеси
Учитель. Выясним, отличаются ли смеси по внешнему виду друг от друга.
Учитель демонстрирует примеры суспензий (речной песок + вода), эмульсии (растительное масло + вода) и растворов (воздух в колбе, поваренная соль + вода, разменная монета: алюминий + медь или никель + медь).
Учитель. В суспензиях видны частицы твердого вещества, в эмульсиях – капельки жидкости, такие смеси называются неоднородными (гетерогенными), а в растворах компоненты не различимы, они являются однородными (гомогенными) смесями. Рассмотрим схему классификации смесей (схема 1).
Схема 1

Приведите примеры каждого вида смесей: суспензий, эмульсий и растворов.
Способы разделения смесей
Учитель. В природе вещества существуют в виде смесей. Для лабораторных исследований, промышленных производств, для нужд фармакологии и медицины нужны чистые вещества.
Для очистки веществ применяются различные способы разделения смесей (схема 2).
Схема 2
Эти способы основаны на различиях в физических свойствах компонентов смеси.
Рассмотрим способы разделения гетерогенных смесей .
Как можно разделить суспензию – смесь речного песка с водой, т. е. очистить воду от песка?
Ученик. Отстаиванием, а затем фильтрованием.
Учитель. Верно. Разделение отстаиванием основано на различных плотностях веществ. Более тяжелый песок оседает на дно. Так же можно разделить и эмульсию: отделить нефть или растительное масло от воды. В лаборатории это можно сделать с помощью делительной воронки. Нефть или растительное масло образует верхний, более легкий слой . (Учитель демонстрирует соответствующие опыты.)
В результате отстаивания выпадает роса из тумана, осаждается сажа из дыма, отстаиваются сливки в молоке.
А на чем основано разделение гетерогенных смесей с помощью фильтрования ?
Ученик. На различной растворимости веществ в воде и на различных размерах частиц.
Учитель. Верно, через поры фильтра проходят лишь соизмеримые с ними частицы веществ, в то время как более крупные частицы задерживаются на фильтре. Так можно разделить гетерогенную смесь поваренной соли и речного песка .
Ученик показывает опыт : наливает в смесь песка и соли воду, перемешивает, а затем пропускает взвесь (суспензию) через фильтр – раствор соли в воде проходит через фильтр, а крупные частицы нерастворимого в воде песка остаются на фильтре.
Учитель. А какие вещества можно использовать в качестве фильтров?
Ученик. В качестве фильтров можно использовать различные пористые вещества: вату, уголь, обожженную глину, прессованное стекло и другие.
Учитель. Какие примеры применения фильтрования в жизни человека вы можете привести?
Ученик. Способ фильтрования – это основа работы бытовой техники, например пылесосов. Его используют хирурги – марлевые повязки; буровики и рабочие элеваторов – респираторные маски. С помощью чайного ситечка для фильтрования чаинок Остапу Бендеру – герою произведения Ильфа и Петрова – удалось забрать один из стульев у Эллочки Людоедки («Двенадцать стульев»).
Учитель. А теперь, познакомившись с этими способами разделения смеси, давайте поможем героине русской народной сказки «Василиса Прекрасная» .
Ученик. В этой сказке Баба-Яга приказала Василисе отделить рожь от чернушки и мак от земли. Героине сказки помогли голуби. Мы же теперь можем разделить крупы фильтрованием через сито, если крупинки имеют разные размеры, или взбалтыванием с водой, если частицы имеют разную плотность или различную смачиваемость водой. Возьмем в качестве примера смесь, состоящую из крупинок различного размера: смесь манной и гречневой круп. (Ученик показывает, как манка с меньшими размерами частиц проходит через сито, а гречка остается на нем.)
Учитель. А вот со смесью веществ, имеющих разную смачиваемость водой, вы сегодня уже знакомились. О какой смеси я говорю?
Ученик. Речь идет о смеси порошков железа и серы. Мы проводили с этой смесью лабораторный опыт .
Учитель. Вспомните, как вы разделяли такую смесь.
Ученик. С помощью отстаивания в воде и с помощью магнита.
Учитель. Что вы наблюдали, разделяя смесь порошков железа и серы с помощью воды?
Ученик. Несмачивающийся порошок серы всплывал на поверхность воды, а тяжелый смачивающийся порошок железа оседал на дно .
Учитель. А как происходило разделение этой смеси с помощью магнита?
Ученик. Порошок железа притягивался магнитом, а порошок серы – нет .
Учитель. Итак, мы познакомились с тремя способами разделения гетерогенных смесей: отстаиванием, фильтрованием и действием магнитом. А теперь рассмотрим способы разделения гомогенных (однородных) смесей . Вспомните, после отделения фильтрованием песка мы получили раствор соли в воде – гомогенную смесь. Как из раствора выделить чистую соль?
Ученик. Выпариванием или кристаллизацией .
Учитель демонстрирует опыт: вода испаряется, а в фарфоровой чашке остаются кристаллы соли.
Учитель. При выпаривании воды из озер Эльтон и Баскунчак получают поваренную соль. Этот способ разделения основан на различии в температурах кипения растворителя и растворенного вещества.
Если вещество, например сахар, разлагается при нагревании, то воду испаряют неполностью – упаривают раствор, а затем из насыщенного раствора осаждают кристаллы сахара.
Иногда требуется очистить от примесей растворители с меньшей температурой кипения, например воду от соли. В этом случае пары вещества необходимо собрать и затем сконденсировать при охлаждении. Такой способ разделения гомогенной смеси называется дистилляцией, или перегонкой .
Учитель показывает перегонку раствора медного купороса, вода испаряется при t кип = 100 °С, затем пары конденсируются в пробирке-приемнике, охлаждаемой водой в стакане.
Учитель. В специальных приборах – дистилляторах получают дистиллированную воду, которую используют для нужд фармакологии, лабораторий, систем охлаждения автомобилей.
Ученик демонстрирует рисунок сконструированного им «прибора» для дистилляции воды.

Учитель. Если же разделять смесь спирта и воды, то первым будет отгоняться (собираться в пробирке-приемнике) спирт с t кип = 78 °С, а в пробирке останется вода. Перегонка используется для получения бензина, керосина, газойля из нефти.
Особым методом разделения компонентов, основанным на различной поглощаемости их определенным веществом, является хроматография .
Учитель демонстрирует опыт. Он подвешивает полоску из фильтровальной бумаги над сосудом с красными чернилами, погружая в них лишь конец полоски. Раствор впитывается бумагой и поднимается по ней. Но граница подъема краски отстает от границы подъема воды. Так происходит разделение двух веществ: воды и красящего вещества в чернилах.
Учитель. С помощью хроматографии русский ботаник М.С.Цвет впервые выделил хлорофилл из зеленых частей растений. В промышленности и лабораториях вместо фильтровальной бумаги для хроматографии используют крахмал, уголь, известняк, оксид алюминия. А всегда ли требуются вещества с одинаковой степенью очистки?
Ученик. Для различных целей необходимы вещества с различной степенью очистки. Воду для приготовления пищи достаточно отстоять для удаления примесей и хлора, используемого для ее обеззараживания. Воду для питья нужно предварительно прокипятить. А в химических лабораториях для приготовления растворов и проведения опытов, в медицине необходима дистиллированная вода, максимально очищенная от растворенных в ней веществ. Особо чистые вещества, содержание примесей в которых не превышает одной миллионной процента, применяются в электронике, в полупроводниковой, ядерной технике и других точных отраслях промышленности .
Учитель. Послушайте стихотворение Л.Мартынова «Дистиллированная вода»:
Вода
Благоволила
Литься!
Она
Блистала
Столь чиста,
Что ни напиться,
Ни умыться.
И это было неспроста.
Ей не хватало
Ивы, тала
И горечи цветущих лоз,
Ей водорослей не хватало
И рыбы, жирной от стрекоз.
Ей не хватало быть волнистой,
Ей не хватало течь везде.
Ей жизни не хватало
Чистой –
Дистиллированной воде!
Для закрепления и проверки усвоения материала учащиеся отвечают на следующие вопросы .
1. При измельчении руды на горно-обогатительных фабриках в нее попадают обломки железных инструментов. Как их можно извлечь из руды?
2. Перед переработкой бытового мусора, а также бумажной макулатуры необходимо избавиться от железных предметов. Как проще всего это сделать?
3. Пылесос всасывает воздух, содержащий пыль, а выпускает чистый. Почему?
4. Вода после мойки автомобилей в крупных гаражах оказывается загрязненной машинным маслом. Как следует поступить перед сливом ее в канализацию?
5. Муку очищают от отрубей просеиванием. Почему это делают?
6. Как разделить зубной порошок и поваренную соль? Бензин и воду? Спирт и воду?
Л и т е р а т у р а
Аликберова Л.Ю.
Занимательная химия. М.:
АСТ-Пресс, 1999; Габриелян О.С., Воскобойникова
Н.П., Яшукова А.В.
Настольная книга учителя.
Химия. 8 класс. М.: Дрофа, 2002; Габриелян О.С.
Химия.
8 класс. М.: Дрофа, 2000; Гузей Л.С., Сорокин В.В.,
Суровцева Р.П.
Химия. 8 класс. М.: Дрофа, 1995; Ильф
И.А., Петров Е.П.
Двенадцать стульев. М.:
Просвещение, 1987; Кузнецова Н.Е., Титова И.М., Гара
Н.Н., Жегин А.Ю.
Химия. Учебник для учащихся 8
класса общеобразовательных учреждений. М.:
Вентана-Граф, 1997; Рудзитис Г.Е., Фельдман Ф.Г.
Химия. Учебник для 8 класса общеобразовательных
учреждений. М.: Просвещение, 2000; Тыльдсепп А.А.,
Корк В.А
. Мы изучаем химию. М.: Просвещение, 1998.
Каждое вещество обладает присущим только ему набором свойств, однако эти свойства являются вполне определенными только для отдельно взятого индивидуального вещества, не смешанного с другими веществами. Поэтому необходимо отличать чистые вещества от смесей веществ.
ЧИСТЫЕ ВЕЩЕСТВА
Физические и химические свойства постоянны, если вещество является чистым.
Примерами практически чистых веществ могут служить некоторые металлы, у которых содержание примесей не превышает нескольких сотых или тысячных долей процента по массе. Например, медь с чистотой 99,99 % или слитки золота, в которых его содержание выражается цифрами 99,999 %. Это означает, что на 100 000 атомов металла приходится лишь 1 другой атом.
Чистыми называют вещества, не содержащие примесей других веществ. Любое чистое вещество обладает присущим только ему набором свойств. Постоянство свойств является признаком чистоты вещества.
СМЕСИ ВЕЩЕСТВ
В природе вещества почти никогда не встречаются в чистом виде. Одни вещества смешаны вместе с другими образуют смеси.
Если смесь почти целиком состоит из одного вещества, то ее обычно называют так же, как и само это вещество. Примеры смесей, с которыми вы встречаетесь в повседневной жизни, даны на рисунке.
Можно заметить, что эти смеси состоят из нескольких составных частей — компонентов.

Минералы - смесь нескольких веществ


Молоко - неоднородная смесь
РАЗДЕЛЕНИЕ СМЕСЕЙ
Чистые вещества встречаются редко, например, в химических лабораториях, в аптеке, на химических предприятиях (примеры чистых веществ - на рисунке).

Чтобы их получить, необходимо научиться разделять смеси и выделять каждое вещество в отдельности. Для этого существуют различные методы разделения смесей.
РАЗДЕЛЕНИЕ НЕОДНОРОДНЫХ СМЕСЕЙ
Один из самых простых методов разделения — отстаивание . Этот метод основан на различной плотности компонентов смеси и может быть использован для разделения неоднородных смесей двух жидких веществ (например, бензин — вода), жидкого и твердого вещества (например, песок — вода).
Такой метод, как фильтрование , основан на способности некоторых пористых материалов задерживать частицы, размер которых больше размера пор данного материала. С помощью фильтрования можно разделить неоднородные смеси твердого и жидкого веществ (мел — вода, глина — вода).


Разделение смесей различных веществ, с помощью отстаивания и фильтрования
РАЗДЕЛЕНИЕ ОДНОРОДНЫХ СМЕСЕЙ
- Выпаривание . Метод основан на различии температур кипения компонентов смеси и может быть использован для разделения однородных смесей твердых и жидких веществ (соль — вода, сахар — вода). Метод выпаривания обычно используется тогда, когда из однородной смеси твердого и жидкого веществ необходимо выделить только твердое вещество.


Выпаривание. Выпаривание соли на соляном озере
- Дистилляция (или перегонка) основан на разности температур кипения компонентов смеси. Чаще всего дистилляцию применяют для разделения однородных смесей нескольких жидких компонентов или твердого и жидкого компонентов. В отличие от метода выпаривания дистилляцию применяют для выделения из смеси всех компонентов. В химических лабораториях с помощью этого метода получают дистиллированную воду, не содержащую растворенных солей. В странах Ближнего Востока этот метод широко используется для получения питьевой воды из морской.

Лабораторная установка для перегонки жидкостей
Итак, сегодня мы узнали:
Чистыми называют вещества, которые не содержат примесей других веществ;
Чистое вещество обладает постоянными свойствами, по которым его можно отличить от других веществ;
Смеси бывают однородные и неоднородные;
Выделить вещества из неоднородной смеси можно с помощью отстаивания и фильтрования;
Выделить вещества из однородной смеси можно с помощью выпаривания и дистилляции.
Пройти тест по параграфу
Вся наша жизнь в буквальном смысле построена на работе различных химических веществ. Мы дышим воздухом, который содержит в себе множество различных газов. На выходе получается углекислый газ, который затем перерабатывается растениями. Мы пьем воду или молоко, которое представляет собой смесь воды с другими компонентами (жиром, минеральными солями, белком и так далее).
Банальное яблоко - это целый комплекс которые взаимодействуют друг с другом и нашим организмом. Как только что-то попадает в наш желудок, вещества, входящие в продукт, поглощенный нами, начинают взаимодействие с желудочным соком. Абсолютно каждый объект: человек, овощ, животное - это набор частиц и веществ. Последние делятся на два разных типа: чистые вещества и смеси. В данном материале разберемся, какие вещества чистые, а какие из них относятся к категории смесей. Рассмотрим А также взглянем на типичные примеры чистых веществ.
Чистые вещества
Итак, в химии чистые вещества - это те вещества, что всегда состоят только из одного-единственного вида частиц. И это первое важное свойство. Чистым веществом является вода, например, которая состоит исключительно из молекул воды (то есть своих собственных). Также чистое вещество всегда имеет постоянный состав. Таким образом, каждая молекула воды состоит из двух атомов водорода и из одного атома кислорода.
Свойства чистых веществ, в отличие от смесей имеют постоянный характер и изменяются при появлении примесей. Только дистиллированная вода имеет температуру кипения, а морская кипит при более высокой температуре. При этом стоит учитывать, что любое чистое вещество не является абсолютно чистым, так как даже чистый алюминий имеет примесь в составе, хоть она и имеет долю в 0.001 %. Возникает вопрос, как выяснить массу чистого вещества? Формула для вычисления выглядит следующим образом - m (масса) чистого вещества = W (концентрация) чистого вещества * смесь / 100 %.
Также существует такой тип чистых веществ, как особо (ультрачистые, высокочистые). Такие вещества используются в производстве полупроводников в различных измерительных и вычислительных устройствах, атомной энергетике и во многих других профессиональных областях.

Примеры чистых веществ
Мы уже выяснили, что чистым веществом является то, что содержит в себе элементы одного вида. Хорошим примером чистого вещества может послужить снег. По сути это та же вода, но в отличие от той воды, с которой мы сталкиваемся ежедневно, эта вода гораздо чище и не содержит примесей. Алмаз тоже является чистым веществом, поскольку он содержит в себе только углерод без примесей. Это же относится и к горному хрусталю. На ежедневной основе мы сталкиваемся с еще одним примером чистого вещества - рафинированным сахаром, который содержит в себе одну лишь сахарозу.
Смеси
Мы уже рассмотрели чистые вещества и примеры чистых веществ, теперь перейдем к другой категории веществ - смесям. Смесь - это когда несколько веществ смешиваются друг с другом. Мы сталкиваемся со смесями на постоянной основе даже в быту. Тот же чай или мыльный раствор представляют собой смеси, которые мы применяем ежедневно. Смеси могут быть созданы человеком, а могут быть природными. Они находятся в твердом, жидком и газообразном состоянии. Как уже было сказано выше, тот же чай является смесью воды, сахара и чая. Это пример смеси, созданной человеком. Молоко является природной смесью, так как оно появляется без участия человека в процессе выработки и содержит в себе множество разных компонентов.

Смеси созданные человеком почти всегда долговечны, а природные под воздействием тепла начинают распадаться на отдельные частицы (молоко, к примеру, прокисает через несколько дней). Смеси также делятся на гетерогенные и гомогенные. Гетерогенные смеси являются неоднородными, а их компоненты видны невооруженным взглядом и под микроскопом. Такие смеси именуют взвесями, которые в свою очередь делят на суспензии (вещество в твердом состоянии и вещество в жидком состоянии) и эмульсии (два вещества в жидком состоянии). Гомогенные смеси однородные, а их отдельные компоненты невозможно рассмотреть. Их также именуют растворами (могут быть веществами в газообразном, жидком или твердом состоянии).
Характеристики смеси и чистых веществ
Для удобства восприятия информация представлена в виде таблицы.
Сравнительный признак | Чистые вещества | Смеси |
Состав веществ | Сохраняют постоянный состав | Имеют непостоянный состав |
Виды веществ | Включают в себя различные вещества |
|
Физические свойства | Сохраняют постоянные физические свойства | Имеют непостоянные физические свойства |
Изменение энергии вещества | Изменяется при образовании энергии | Не изменяется |

Способы получения чистых веществ
В природе многие вещества существуют в Они применяются в фармакологии, промышленном производстве.
Для получения чистых веществ применяются различные методы разделения. Гетерогенные смеси делят с помощью отстаивания и фильтрования. Гомогенные смеси делят с помощью выпаривания и дистилляции. Рассмотрим каждый способ отдельно.
Отстаивание
Этот метод используется для разделения суспензий, таких как смесь речного песка с водой. Главным принципом, на котором основывается процесс отстаивания, является разница в плотностях тех веществ, которые будут разделены. Например, одно тяжелое вещество и вода. Какие чистые вещества тяжелее воды? Это песок, например, который в силу своей массы начнет оседать на дно. Таким же образом разделяют различные эмульсии. Например, от воды можно отделить растительное масло или нефть. Эти вещества в процессе разделения образуют небольшую пленку на поверхности воды. В лабораторных условиях этот же процесс проводят с использованием делительной воронки. Этот способ разделения смесей работает и в природе (без участия человека). Например, осаждение сажи из дыма и отстаивание сливок в молоке.

Фильтрование
Этот метод подходит для получения чистых веществ из гетерогенных смесей, например, из смеси воды с поваренной солью. Итак, каким образом работает фильтрация в процессе разделения частиц смеси? Суть заключается в том, что у веществ различные уровни растворимости и размеры частиц.
Фильтр конструируется таким образом, чтобы через него могли пройти только частицы с той же растворимостью или тем же размером, что он может пропустить. Более крупные и другие неподходящие частицы не смогут пройти через фильтр и будут отсеяны. Роль фильтров могут играть не только специализированные устройства и растворы в пределах лаборатории, но и знакомые всем вещи, такие как вата, уголь, обожженная глина, спрессованное стекло и другие пористые объекты. Фильтры используются в реальной жизни гораздо чаще, чем может показаться.
По такому принципу работает всем нам знакомый пылесос, который отделяет крупные частицы мусора и ловко всасывает мелкие, неспособные повредить механизм. Когда вы болеете, то надеваете марлевую повязку, которая может отсеять бактерии. Рабочие, чья профессия связана с распространением опасных газов и пыли, носят защищающие их от отравления.

Воздействие магнита и воды
Таким способом можно разделить смесь порошка железа и серы. Принцип разделения основан на воздействии магнита на железо. Частицы железа притягиваются к магниту, в то время как сера останется на месте. Этот же метод можно использовать для отделения других металлических деталей из общей массы разных материалов.
Если порошок серы, смешанный с порошком железа высыпать в воду, то несмачиваемые частицы серы всплывут на поверхность воды, в то время как тяжелое железо сразу же ляжет на дно.
Выпаривание и кристаллизация
Этот способ работает с такими как раствор соли в воде. Это работает в естественных природных процессах и лабораторных условиях. Например, некоторые озера при нагревание испаряют воду, а на ее месте остается поваренная соль. С точки зрения химии, этот процесс основывается на том, что разница между температурой кипения двух веществ, не позволяет им испариться единовременно. Уничтоженная вода обратится в пар, а оставшаяся соль останется в своем обычном состоянии.
Если вещество, которое нужно извлечь (сахар, например) плавится при нагревании, то воду не испаряют полностью. Смесь сначала прогревают, а затем получившуюся модифицированную смесь настаивают, чтобы частицы сахара осели на дне. Иногда стоит более сложная задача - отделение вещества с более высокой температурой кипения. Например, отделение воды от соли. В таком случае, испаренное вещество необходимо собрать, охладить и сконденсировать. Этот метод разделения гомогенных смесей называют дистилляцией (или просто перегонкой). Существуют специальные устройства, которые дистиллируют воду. Такая вода (дистиллированная) активно используется в фармакологии или в автомобильных системах охлаждения. Естественно, этим же методом люди перегоняют спирт.

Хроматография
Последний метод отделения - хроматография. Он основан на том, что некоторые вещества имеют свойство поглощать другие компоненты веществ. Это работает следующим образом. Если вы возьмете кусочек бумаги или ткани, на которой что-то написано чернилами и погрузите ее часть в воду, то заметите следующее: вода начнет впитываться бумагой или тканью и будет ползти вверх, а вот красящее вещество будет немного отставать. Используя данную методику ученый М. С. Цвет смог отделить хлорофилл (вещество, дающее зеленый окрас растениям) от зеленых частей растения.
В смеси исходные вещества включены неизменными. При этом нередко исходные вещества становятся неузнаваемыми, потому что смесь обнаруживает другие физические свойства по сравнению с каждым изолированным исходным веществом. При смешивании не возникает, тем не менее, никакое новое вещество.
Специфические качества смеси, например, плотность, температура кипения или цвет, зависят от соотношения компонентов смеси (массовое отношение). Смесь двух металлов, полученная путём смешивания их расплавов, называется сплавом . В другой связи говорят о конгломерате. Коллоидные растворы находятся посередине между гомогенными и гетерогенными смесями. В этих жидкостях примешаны твердые частички, каждая из которых состоит из небольшого числа молекул. Поэтому такая смесь ведёт себя как раствор.
Если хотят разделить смесь на чистые вещества, то используют некоторые физические качества. Из этого получается выбор соответствующего разделительного метода.
Гомогенные и гетерогенные смеси
Различные виды смесей можно классифицировать в 2 группы:
- Гетерогенные смеси полностью не смешаны, так как чистые вещества существуют в ясно отграниченных фазах, то есть это многофазные материалы
- Гомогенные смеси - это на молекулярном уровне смешанные чистые вещества, то есть это однофазные материалы.
Гомогенные смеси делятся по агрегатному состоянию на три группы:
- газовые смеси;
- растворы;
- твёрдые растворы.
Гетерогенные смеси двух веществ можно разделить по агрегатным состояниям на следующие группы:
Мерой, указывающей доли веществ в смеси, является концентрация .
Различие между чистыми веществами и смесями
Наиболее простым такое различие является для газов. Чистое сложное вещество (например, вода), состоит из одного типа молекул, а смесь газов - из нескольких типов (например, молекул кислорода и водорода). Смесь газов можно разделить физическими методами (например, диффузионным), а сложное вещество - нельзя.
В отношении жидких и твёрдых смесей не всегда всё очевидно.
Разделение смесей
Существуют различные методы разделения смесей. Для газов эти методы основаны на разнице в скоростях либо массах молекул веществ, входящих в смесь.
1. Основные способы выделения веществ из неоднородной (гетерогенной) смеси:
- отстаивание
- фильтрование
- действие магнитом
2. Основние способы выделения веществ из однородной (гомогенной) смеси:
- выпаривание
- кристаллизация
- дистилляция
- хроматография
См. также
Примечания
Wikimedia Foundation . 2010 .
Смотреть что такое "Смесь (химия)" в других словарях:
Смесь: Смесь (химия) продукт смешения, механического соединения каких либо веществ, характеризующаяся содержанием примесей выше определенного предела. Например: горючая смесь, гелиево кислородная смесь. Случайная, беспорядочная, лишенная… … Википедия
Смесь золошлаковая - Смесь золошлаковая – смесь, состоящая из золы и шлака, образующихся на тепловых электростанциях при сжигании углей в топках котлоагрегатов. [ГОСТ 25137 82] Смесь золошлаковая – механическая смесь пылеобразной золы уноса и шлаковых… …
- (Eschka mixture) смесь двух частей MgO и одной части Na2CO3, реагент, хорошо поглощающий окислы серы и хлора. Например, для определения содержания серы в угле, навеску угля сжигают со смесью Эшка. При этом образуются растворимые сульфаты… … Википедия
Смесь активированная сфб - – смесь, приготовленная на воде с добавками, пропущенной через роторно пульсационный аппарат и подверженной кавитации; позволяет получить экономический эффект за счет увеличения удельной поверхности цемента и образования цементно… … Энциклопедия терминов, определений и пояснений строительных материалов
Смесь асфальтобетонная - – рационально подобранная смесь минеральных материалов [щебня (гравия) и песка с минеральным порошком или без него] с битумом, взятых в определенных соотношениях и перемешанных в нагретом состоянии. [ГОСТ 9128 97] Рубрика термина: Асфальт… … Энциклопедия терминов, определений и пояснений строительных материалов
Смесь бетонная заданного качества - – это бетонная смесь, требуемые свойства и дополнительные характеристики которой задаются производителю, который несет ответственность за обеспечение этих требуемых свойств и дополнительных характеристик. [ГОСТ 7473 2010] Рубрика термина:… … Энциклопедия терминов, определений и пояснений строительных материалов
Смесь бетонная заданного нормированного состава - – это бетонная смесь заданного состава, состав которого определен стандартом или другим техническим документом, например, производственными нормами. [ГОСТ 7473 2010] Рубрика термина: Свойства бетона Рубрики энциклопедии: Абразивное… … Энциклопедия терминов, определений и пояснений строительных материалов
Смесь бетонная заданного состава - – это бетонная смесь, состав которой и используемые при приготовлении составляющие задаются производителю, который несет ответственность за обеспечение этого состава. [ГОСТ 7473 2010] Рубрика термина: Свойства бетона Рубрики энциклопедии:… … Энциклопедия терминов, определений и пояснений строительных материалов
Смесь бетонная огнеупорная - – огнеупорная смесь, состоящая из огнеупорных порошков и огнеупорного цемента, готовая к использованию после введения жидкости. [ГОСТ Р 52918 2008] Рубрика термина: Технологии бетонирования Рубрики энциклопедии: Абразивное оборудование,… … Энциклопедия терминов, определений и пояснений строительных материалов
Смесь огнеупорная - – неформованный огнеупор, состоящий из огнеупорных порошков, готовый к использованию после введения связки. [ГОСТ Р 52918 2008] Смесь огнеупорная – неформованные огнеупоры, состоящие из огнеупорных порошков, требующие введения связки. [ГОСТ … Энциклопедия терминов, определений и пояснений строительных материалов
Книги
- Основы общей и физической химии. Учебное пособие , Еремин Вадим Владимирович, Борщевский Андрей Яковлевич. Книга создается на основе годичного курса`Общая и физическая химия`для студентов 2-го курса физического факультета МГУ. Выбирая уровень изложения, мы исходили из того, что читать ее будут…