ВОЕННО-МЕДИЦИНСКАЯ АКАДЕМИЯ
Э.В. Бойко
ЛАЗЕРЫ В ОФТАЛЬМОХИРУРГИИ:
ТЕОРЕТИЧЕСКИЕ И ПРАКТИЧЕСКИЕ ОСНОВЫ
Учебное пособие
Санкт-Петербург 2003
Цель пособия - помочь врачам-офтальмологам систематизировать знания в базисных аспектах лазерной биологии и медицины с целью эффективного применения лазерных технологий в клинической практике.
Предназначено для врачей-офтальмологов, клинических ординаторов, а также специалистов, связанных с лазерной медициной.
© Бойко Э.В., 2003
© ВМедА, 2003
Введение
Офтальмология - это специальность, которая наиболее успешно использует все достижения лазерных технологий со времени появления первых лазеров в 1960 году. Как результат - появление и внедрение в клиническую практику значительного количества новых методик лечения, высокоэффективных в руках специально подготовленных офтальмологов. Расширению практических возможностей лазерной офтальмохирургии способствует создание новых, портативных, удобных и доступных лазерных аппаратов, которые можно с успехом использовать во многих поликлиниках и стационарах. Однако порой недостаток информации у врачей при таком многообразии способов лазерных вмешательств и нового технического оснащения сдерживает внедрение современных методов лечения. В этих условиях глубокое изучение основ лазерных воздействий - это единственный путь для того, чтобы не растеряться в мире новых лазерных аппаратов и методик. Данное пособие призвано систематизировать основные понятия лазерной хирургии применительно к офтальмологии. Учебное пособие предназначено для врачей-офтальмологов, клинических ординаторов и будет полезно всем, интересующимся лазерной медициной.
Краткий исторический экскурс
Применение светового излучения для бесконтактной и неинвазивной доставки энергии к структурам глаза открыло новую эру в истории офтальмохирургии. Благодаря энтузиазму и пионерским работам G. Meyer-Schvickerath, а также других ученых, началось изучение возможностей применения света (сначала - солнечного, затем от электрических источников и ксеноновых ламп) в сороковых и пятидесятых годах прошлого столетия. В результате этих работ стали очевидными преимущества световой хирургии перед традиционной и в клиническую практику был внедрен и эффект фотокоагуляция тканей глаза. В разработке и создании первых оптических квантовых генераторов - лазеров - большую роль сыграли работы отечественных ученых Н.Г. Басова и A.M. Прохорова, а также американского исследователя Ч. Таунса, за что эти ученые в 1964 году были удостоены Нобелевской премии. В 1960 году был создан первый лазер, и благодаря этому произошла революция в оптике и других областях науки: появились источники управляемого интенсивного когерентного излучения, позволяющие сконцентрировать высокую энергию в очень малых спектральных, пространственных и временных диапазонах.
Неудивительно, что как только появились первые лазеры, их биологическое действие было изучено в эксперименте, а затем лечебные возможности применены в клинике. Прозрачные для видимого света среды: роговица, хрусталик, стекловидное тело давали возможность неинвазивно доставить излучение этого диапазона к тканям глазного дна и коагулировать их. Очевидно поэтому методика лазеркоагуляции глазного дна была разработана первой (Campbell C.J., Zweng H.C. и др., 1963) и поныне остается одной из самых распространенных в офтальмологии. Следующим значительным шагом вперед было клиническое использование эффекта фоторазрыва для разрушения вторичной катаракты и для базальной иридэктомии при глаукоме в семидесятых годах XX столетия (М.М. Краснов). Немало было сделано в области лазерной офтальмохирургии благодаря многолетнему сотрудничеству кафедры офтальмологии ВМедА и Государственного Оптического института им. С.И. Вавилова (В.В. Волков, В.П. Жохов, Л.И. Балашевич, Ю.Д. Березин, А.Ф. Гацу, Э.В. Бойко). Были разработаны, созданы и всесторонне изучены в эксперименте и клинике первые отечественные коагуляторы для наружных отделов глаза, внутренних его оболочек, для офтальмоонкологии, эндолазерные диссекторы для витреоретинальной хирургии.
После открытия эффекта абляционной фотодекомпозиции с помощью ультрафиолетовых лазеров (Srinivasan, 1982), началось интенсивное экспериментальное, а затем и клиническое изучение этого эффекта. В последнее время эксимерные лазеры позволили качественно изменить подход к рефракционной хирургии роговицы (С.Н. Федоров, А.Д. Семенов).
В настоящее время трудно даже сосчитать количество применяемых для лечения глазных заболеваний лазерных методов и их число постоянно возрастает. Очень краткая историческая справка свидетельствует о том, что развитие лечебных методик базируется на использовании определенных биологических эффектов «лазерное излучение-биоткань», которые необходимо всегда учитывать в практической работе. Хронология внедрения эффектов «лазерное излучение-биоткань» в клиническую практику представлена на рис. 1.
Рис. 1. Диаграмма внедрения в клиническую офтальмологию световых методов лечения и различных биоэффектов.
Физико-технические аспекты применения лазеров
Для понимания сущности лазерных методик, применяемых в офтальмологии, необходимо знать некоторые физические, химические и биологические понятия, а также представлять техническое устройство лазерных аппаратов.
Лазерное излучение - вынужденное, индуцированное излучение, генерируемое в результате перехода электронов с нестабильного верхнего энергетического уровня, на стабильный низший уровень. Аббревиатура LASER означает сокращение от «Light Amplification by Stimulated Emission of Radiation». Излучение лазера характеризуется:
- монохроматичностью - одной длиной волны, что дает возможность выбора и применения конкретной длины волны;
- коллимированностью - малой расходимостью пучка, почти параллельностью всех лучей в пучке, что позволяет создать в малом пятне большие плотности энергии или мощности;
- пространственной и временной когерентностью (совпадением фаз волны в пространстве и во времени), свойство используют преимущественно в диагностических методиках.
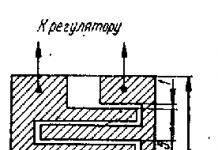
Устройство лазера. Разнообразие видов оптических квантовых генераторов или лазеров объединено их принципиально одинаковой конструкцией: установка имеет активную среду, элементы накачки, систему зеркал для усиления излучения и средства доставки излучения. Принципиальная схема устройства лазера представлена на рис. 2.

Рис. 2. Принципиальная схема устройства лазера. Объяснение в тексте.
Активная среда (1) - кристалл, раствор, газ или полупроводник обеспечивает конкретную длину волны в зависимости от своего химического состава. Строго определенная длина волны излучения связана с одинаковой разницей в энергетических уровнях электронов в молекулах вещества.
Элементы накачки (2) служат для специфического насыщения энергией активной среды (заселения верхних энергетических уровней). Накачка может быть оптической (мощные лампы, а также электрической, лазерной, химической и даже тепловой. В связи с происходящим побочным нагреванием лазерных установок от элементов накачки, приходится охлаждать аппараты водой или воздухом.
Система зеркал (3, 4) служит для усиления излучения и состоит из параллельных пластин, одна из которых является непрозрачным зеркалом и полностью отражает излучение (3), а вторая - это полупрозрачное зеркало (4), через которое лазерный луч (5) выходит из генератора. Зеркала, отражая часть излучения в активное вещество, играют роль «открытого резонатора», обеспечивая многократное усиление и направленность генерируемого излучения.
Средства доставки излучения представляют собой оптические системы, доставляющие к мишени лазерный луч. К ним относятся оптические адаптеры к щелевой лампе, операционному микроскопу, налобному бинокулярному офтальмоскопу, волоконнооптические инструменты, сканирующие и другие системы. Несмотря на многообразие их конструкций, размеров и форм, принципиально на выходе возможны лишь три варианта пространственного распределения излучения: это коллимированный, расходящийся или сходящийся пучок. (рис. 3). Очевидно, что для решения тех или иных практических задач подбирается один из трех вариантов.
Лазерная аппаратура. Названия лазерные установки получают, как правило, в соответствии с активной средой и наиболее общая классификация включает твердотельные, газовые, полупроводниковые, жидкостные лазеры. К твердотельным относятся рубиновый, неодимовый, александритовый, гольмиевый, эрбиевый; к газовым - аргоновый, эксимерный, на парах меди; к жидкостным - работающие на растворах красителей и другие лазеры, ставшие уже классическими. В последние годы, в буквальном смысле слова, революцию совершило появление полупроводниковых лазеров по причине их экономичности за счет высокого коэффициента полезного действия (до 60 - 80% в отличие от 10-30% при традиционных), малогабаритности, надежности. Однако продолжают с успехом использоваться и другие типы лазеров.
Рис. 3. Формы пучков лазерных лучей, выходящих из средств доставки излучения.
Описание технических характеристик каждой модели является прерогативой специальной литературы и выходит за рамки данного пособия. Более того, далее будут рассмотрены только те общие физические понятия и процессы, которые необходимы для понимания сущности лазерных методик и практической работы врача. К примеру, для офтальмолога термин «зеленый» лазер вполне может заменить такие технические названия, как «аргоновый» или «неодимовый с удвоенной частотой» лазеры, поскольку объединяет их длина волны, идентичная по своему биологическому эффекту. Поэтому с клинической точки зрения представляется необходимым рассмотреть те биологические эффекты взаимодействия «лазерное излучение-биоткань», которые влияют на конечный результат лечения.
Биологические эффекты взаимодействия «лазерное излучение-биоткань»
Биологические эффекты взаимодействия «лазерное излучение-биоткань» многообразны, но в целом с определенной долей условности их можно разделить на немеханические, при которых непосредственно в ходе лазерного вмешательства дефекта тканей не образуется, механические, связанные с формированием дефекта в процессе воздействия и смешанные.
Немеханические эффекты
Немеханические эффекты возможно разделить на термические и фотохимические.
Наиболее широко представлены термические эффекты.
Гипертермия - длительное, до часа и более прогревание тканей при температуре 43-45 °С, в результате чего наступает отсроченная во времени гибель клеток, наиболее чувствительных к температуре, например, опухолевых.
Термотерапия - прогревание тканей в течение минут при температуре 45 - 60 °С с последующей гибелью клеток, их лизисом и образованием участка атрофии.
Коагуляция ткани связана с денатурацией белков и наступает практически сразу при достижении температуры 60 °С. Участок некроза в последующем замещается соединительной тканью либо образуется дефект тканей.
Сокращение коллагена на 20-30% без денатурации его волокон и, соответственно без некроза, происходит при нагревании его в диапазоне температур 62-64 °С.
Фотохимические эффекты
К фотохимическим эффектам можно отнести стимулирующее, а также цитотоксическое действие лазерного излучения невысоких плотностей мощности в течение длительного времени, не приводящее к нагреву тканей.
Фотодинамическая терапия заключается в предварительном внутривенном введении фотосенсибилизаторов - гематопорфиринов, селективно накапливающихся в клетках патологических тканей (новообразованных сосудов, опухоли) и последующем облучении этих тканей низкоинтенсивным лазерным излучением, не представляющим опасности для окружающих структур, в результате чего вещество фотосенсибилизатора становится токсичным и приводит к избирательному некрозу патологического образования. Таким образом, фотодинамическая терапия реализуется за счет опосредованных фотохимических эффектов, но не за счет нагрева тканей.
Механические эффекты
Испарение свидетельствует о превышении температуры тканей свыше 100 °С, в результате чего происходит парообразование, разрыв тканей, а некротические массы могут обезвоживаться.
Карбонизация или обугливание ткани наступает при температуре 150 °С и выше, при этом непосредственно во время воздействия образуется дефект тканей за счет улетучивания органического субстрата в виде неорганических частиц - дыма. Карбонизация может служить примером механического эффекта, опосредованного повышением температуры тканей.
Фоторазрыв возникает в том случае, если энергия концентрирована в пространстве и во времени настолько, что возникает оптический пробой и ионизация среды-мишени с формированием плазменной микрополости. Во время лазерного воздействия происходит исключительно механический разрыв ткани без признаков ее термического повреждения.
Абляция в чистом виде - это процесс фотодекомпозиции (разрушения межмолекулярных связей ультрафиолетовым излучением) с формированием дефекта тканей и выбросом тканевого детрита из зоны облучения, при котором в продуктах выброса можно идентифицировать удаляемую ткань (в отличие от карбонизации). Иногда термин «абляция» применяют более широко, характеризуя любой процесс лазерного удаления тканей.
17-03-2015, 11:28
Описание
Несомненно, что наибольшие успехи лазерной медицины как в исследовательской, так и в практической областях имеют место в клинической офтальмологии. Первые медико-биологические исследования действия лазерного излучения и успешное использование его в лечебных целях осуществили именно офтальмологи. Это было выполнено в начале 60-х годов на пионере оптических квантовых генераторов- твердотельном лазере на рубине. С тех пор и до настоящего времени практически все вновь создаваемые лазеры являются предметом пристального научного интереса офтальмологов - исследователей и клиницистов.Открыто и изучено множество биологических эффектов действия лазерного излучения на структуры глаза и на их базе разработаны лечебные методы. В клинической офтальмологии нашли практическое применение лазеры от короткого ультрафиолета (УФ) до дальней инфракрасной (ИК) области спектра практически во всем освоенном временном интервале - от фемтосекундных импульсов до непрерывного излучения. В таких странах, как США, Франция, Англия, Россия, Италия, Япония, занимающих передовые позиции в лазерной офтальмологии, удельный вес лазерных хирургических операций, выполняемых как самостоятельно, так и в сочетании с другими методами лечения чрезвычайно высок и достигает 90-95 % при некоторых видах патологии.
В первоначальный период развития лазерной техники она преимущественно использовалась для фиксации внутриглазных оболочек, однако результатом бурного развития лазерных технологий в последующие десятилетия стало внедрение лазерных методов лечения практически во все разделы офтальмологии и ее выделение в качестве самостоятельного направления офтальмологической науки и практики. Как было показано в ряде работ, определенные задачи оказалось возможным решать с помощь лазеров и при последствиях бытовых и боевых повреждений органа зрения. Целью настоящей главы является ознакомление читателя с возможностями современных лазерных технологий в лечении таких состояний.
ТИПЫ ОФТАЛЬМОЛОГИЧЕСКИХ ЛАЗЕРОВ И СВОЙСТВА ИХ ИЗЛУЧЕНИЙ
Действие любого лазера основано на способности некоторых веществ генерировать электромагнитные излучения с особыми свойствами под влиянием внешнего источника энергии (источника накачки). Эти вещества, которые называют активными средами, могут быть кристаллами, например, рубина, алюмоиттриевого граната, активированного неодимом, гольмием, иттербий-эрбием; газами, такими как аргон, смесь гелия и неона, криптон, пары меди. Активными средами могут быть также полупроводники и растворы красителей. Как правило, активная среда определяет и название лазера (аргоновый, рубиновый и т. д). Именно активная среда определяет длину волны и другие параметры излучения лазера. Накачка активной среды чаще всего осуществляется мощным световым источником или электричеством. Под влиянием энергии накачки электроны активной среды возбуждаются, меняют свой энергетический уровень и испускают при этом излучение со свойственными только данной среде характеристиками. Принципиальная схема лазера представлена на рис. 130.
Активная среда, в данном случае кристалл, помещена соосно внутри оптического резонатора, образованного из двух зеркал. Зеркала, одно из которых является полупрозрачным для излучения генерируемой длины волны, расположены строго под углом 90° к оси резонатора. В процессе оптической накачки испускаемое возбужденными атомами стимулированное излучение, совпадающее с направлением оси оптического резонатора, усиливается за счет многократного переотражения от зеркал резонатора при прохождении через активную среду и в конечном итоге выводится со стороны полупрозрачного зеркала. Полученное излучение с помощью оптических элементов или волоконных гибких световодов передается на офтальмологический прибор (щелевая лампа, налобный бинокулярный офтальмоскоп) либо на эндо- или транссклеральные инструменты, через которые оно доставляется к объекту воздействия- тканям глаза.
Лазерное излучение обладает уникальными свойствами по сравнению с излучением обычных полихроматических источников света. Это излучение высококогерентно во времени (монохроматичность) и в пространстве (малая расходимость). Такое излучение можно сфокусировать с помощью оптической системы в объем, размер которого в осевом и ортогональном направлениях в пределе может достигать значений длины волны. Это принципиально недостижимо при использовании обычных оптических источников света из-за их значительных угловых размеров, а также хроматических аберраций, возникающих вследствие разности преломления лучей различных волн, не позволяющих собрать их в одну точку.
В сочетании с такими важными свойствами лазерного луча, как высокие энергетические параметры (мощность, энергия в импульсе) и короткие экспозиции, возможно получать в фокусе оптической системы невиданные для обычных оптических источников света плотности и мощности, достаточные для того, чтобы расплавить или разрушить любой известный на земле материал.
Лазерное излучение имеет свойство сохранять форму волнового фронта колебаний и менять фазу волны с определенной регулярностью в пространстве в точке наблюдения. При взаимодействии излучения с биологическими структурами пространственная когерентность утрачивается вследствие имеющего место процесса рассеяния на клеточных структурных компонентах (мембраны, органеллы, пигментные включения). То есть пространственная когерентность не относится к важным свойствам с точки зрения интересов применения лазеров в лечебных целях. Однако она является определяющей при обосновании большинства медицинских диагностических методов, а также для голографии и некоторых других немедицинских применений.
В настоящее время лазеры перекрывают практически всю гамму оптического диапазона длин волн от ближнего ультрафиолета до дальней инфракрасной области и по этому признаку разделяются на ультрафиолетовые, инфракрасные и работающие в видимом диапазоне (рис. 131).

Важное для медицинской практики свойство лазеров - их способность генерировать излучение в различных временных режимах. Так, большинство твердотельных лазеров излучают свет короткими импульсами длительностью порядка одной или нескольких миллисекунд. К таким лазерам из приведенных на рис. 131 относятся рубиновый, неодимовый и иттербий-эрбиевый, которые называют импульсными. С помощью специальных устройств - фототропных затворов - эти излучаемые в режиме свободной генерации импульсы можно укоротить до нескольких нано- и даже пикосекунд. Эти режимы называют, соответственно, режимами модулированной добротности и синхронизации мод. Первый лазер медицинского назначения «Ятаган», работавший в режиме модулированной добротности, или моноимпульсном режиме, был предложен М. М. Красновым и соавт. в 1974 г. для лечения глаукомы. Во всех импульсных лазерах интенсивность воздействия на ткани можно регулировать только изменением энергии в импульсе.
Большинство газовых лазеров излучают свет непрерывно в течение всего времени накачки и называются, соответственно, лазерами непрерывного излучения. Среди применяемых в офтальмологии к ним относятся аргоновый, криптоновый, лазер на углекислом газе и гелий-неоновый. Для получения импульса нужной длительности эти лазеры снабжаются специальными затворами. Достоинством их является возможность регулировать интенсивность воздействия на ткани с помощью изменения как мощности, так и длительности воздействия.
Наконец, по мощности и, следовательно, по степени опасности излучения для человека лазеры делятся на 4 класса. К лазерам 1-го класса относятся те, излучение которых не представляет опасности для глаз и кожи. К лазерам 2-го класса относятся лазеры, излучение которых может вызвать повреждение глаз прямым или зеркально отраженным излучением. Излучение лазеров 3-го класса опасно для глаз и при диффузном отражении на расстоянии 10 см от отражающей поверхности. К лазерам 4-го класса относятся мощные лазеры, диффузно отраженное излучение которых опасно даже для кожи на том же расстоянии от отражающей поверхности. Большинство используемых в офтальмологии лазеров относятся к 1-му и 2-му классам мощности.
Энергетическая эффективность импульсного лазерного излучения выражается энергией в импульсе и измеряется в джоулях (Дж) или его тысячных долях- миллиджоулях (мДж). Для решения большинства офтальмологических проблем достаточна энергия в импульсе длительностью 10 не порядка 1-8 мДж. Мощность лазеров непрерывного из-
лучения измеряется в ваттах (Вт) или милливаттах (мВт). В офтальмологии чаще всего используются лазерь мощностью до 3 Вт, в общей хирургии- до сотни ватт.
КРИТЕРИИ ВЫБОРА ПАРАМЕТРОВ ЛАЗЕРНОГО ИЗЛУЧЕНИЯ ДЛЯ ЛЕЧЕБНЫХ ЦЕЛЕЙ
Эффект лазерного воздействия на ткани глаза зависит от трех основных параметров лазерного излучения: длины волны, энергетических характеристик (мощности, энергии в импульсе) и режима генерации (непрерывный, импульсный). Рассмотрим значения каждого из них в перечисленной последовательности.Выбор длины волны излучения для воздействия на структуры глазного яблока зависит от их абсорбционных характеристик для каждой из длин волн. Спектр поглощения данной ткани определяется типом основных поглощающих центров, или хромофоров, а также содержащейся в ткани водой. Так, роговица абсорбирует (поглощает) излучение ультрафиолетовой части спектра за счет аминокислот, белков и нуклеиновых кислот, которые играют роль хромофора в этом случае (рис 132), а также ИК-излучение с 1,5 мкм и более, но роль хромофора в этом случае, с ростом длины волны, начинает играть преимущественно содержащаяся в ее ткани вода. Другими словами, роговица является непрозрачной для УФ- и ИК-излучения указанного диапазона, и такие излучения могут быть использованы для воздействия на нее в целях повреждения или лечения. В то же время роговица не содержит хромофоров для видимой в ближней ИК-части спектра, и излучения этих длин волн свободно пропускаются ею, достигая глубжележащих структур.

Оболочки и структурные элементы глазного дна также по-разному поглощают излучения видимого и ближнего ИК-диапазона длин волн, пропускаемого роговицей. Меланиновые гранулы пигментного эпителия и сосудистой оболочки являются лучшим хромофором для этого диапазона длин волн, они поглощают 70 % лучей сине-зеленого цвета, более 50 %- красного и около 15 %- ближнего инфракрасного. Вследствие этого данные излучения могут быть эффективно использованы для воздействия на глазное дно. При этом следует также принимать во внимание, что все гемоглобинсодержащие структуры на глазном дне (сосуды, кровоизлияния) прекрасно поглощают сине-зеленое или чисто зеленое излучение, например, аргонового лазера или N1:VАО-лазеров с удвоением частоты, но слабо поглощают красные лучи, например, криптонового и диодного лазеров, которые вследствие этого неэффективны для прямой коагуляции сосудов.
Необходимо учитывать также особенности абсорбции излучений разных длин волн сетчаткой. Последняя поглощает более 10 % коротковолнового сине-зеленого излучения, что может привести к ее неоправданно массивному повреждению при необходимости коагулировать субретинальные структуры. Опасность повреждения нервных волокон сетчатки еще более возрастает при применении этих длин волн в макулярной области, желтый пигмент которой их интенсивно поглощает. В связи с этим для работы в этой области сетчатки оптимальны лазеры, излучающие в более длинноволновой части спектра, в частности диодный лазер (0,81 мкм). Таким образом, роль длины волны излучения лазеров в конечном результате его воздействия на ткань реализуется в строгой зависимости от спектральных характеристик самой ткани и может быть представлена в виде схемы (рис. 133).

Ориентируясь на данную схему, следует иметь в виду, что роговица по-разному поглощает излучение и в пределах УФ-диапазона. Чем больше длина волны, тем большая часть излучения проникает и в более глубоколежащие образования, в частности во влагу передней камеры и стекловидное тело, а самая длинная часть может достигать и сетчатки, в особенности при афакии.
Такая же закономерность характерна и для излучения ИК-диапазона. Так, излучение полупроводникового лазера длиной волны 0,81 мкм на 97 % проходит через оптические среды и достигает глазного дна, т. е. в таком же проценте, как и видимое красное, и лишь 3 % его поглощают оптические среды. Но при увеличении длины волны до 1 мкм (неодимовый лазер) оптические среды поглощают уже 67 % излучения, и лишь 33 % достигает глазного дна. Отсюда следует, что при использовании данного лазера для коагуляции образований на глазном дне большими дозами излучения неизбежно тепловое повреждение ткани роговицы и хрусталика.
В не меньшей степени эффект лазерного воздействия определяется энергетическими параметрами излучения. Излучение малой плотности мощности порядка 0,1 мВт/см2 не вызывает повреждений биологических тканей, но оказывает биостимулирующий эффект, наличие которого установлено на многих биологических объектах. Точный механизм стимулирующего действия лазерного излучения не ясен до настоящего времени, но предполагается, что в основе его лежит взаимодействие света с фотосенсибилизаторами - веществами, молекулы которых поглощают свет и передают энергию другим молекулам, лишенным этой способности. Ускорение регенераторного процесса под влиянием лазерного воздействия в целом складывается из уменьшения длительности фаз воспаления и интенсификации восстановительных механизмов.
Происходит изменение временных параметров процессов, составляющих эти фазы: сосудистой и макрофагальной реакций, формирования грануляционной ткани, созревания соединительной ткани, восстановления органоспецифичности (полнота дифференцировки специализированных структур). На уменьшение длительности фаз воспалительного процесса указывают многие исследователи, и, что особенно важно, при этом отмечено подавление экссудативной и инфильтративной реакций. Воздействие лазерным излучением на поврежденную ткань приводит к уменьшению интерстициального и внутриклеточного отеков, что связывают с усилением кровотока в тканях, активизацией транспорта веществ через сосудистую стенку, а также с интенсивным формированием сосудов, особенно капилляров. Уменьшение отека и тканевого напряжения в пораженной ткани (очаге поражения), естественно, сопровождается ослаблением болевого синдрома.
Способность лазерного излучения активизировать процессы метаболизма клеток и тканей в наибольшей степени проявляется в условиях патологии. Ускорение дифференцировки клеток и восстановления их функциональной активности лежит в основе лазерной стимуляции собственно регенеративного процесса. Таким образом, лазерное воздействие приводит к своего рода сбалансированности функций отдельных взаимосвязанных и взаимозависимых групп клеточных элементов. Одним из эффектов воздействия лазерного излучения на регенерирующую ткань является повышение митотической активности клеток, при этом происходит изменение временной характеристики митотического цикла- укорачиваются его фазы. Отмечается также снижение количества хромосомных нарушений при делении клеток. Большое значение в чувствительности биологических объектов к лазерному воздействию имеет спектральная характеристика самого субстрата- соответствие максимума поглощения длин волн излучения. В связи с этим лазерную терапию следует проводить с учетом оптических свойств тканей, повышая восприимчивость к лазерному облучению путем нанесения специальных веществ на область непосредственного воздействия.
Излучение мощностью порядка 0,1-1,0 Вт, в зависимости от диаметра и времени воздействия, поглощаясь в ткани, вызывает ее тепловое повреждение, которое проявляется при достижении температуры 45 °С и выше денатурацией и коагуляцией белков. Исходом такого воздействия является слипчивое воспаление, уплотнение ткани за счет образования рубца и ее частичное рассасывание. При дальнейшем увеличении мощности излучения и повышении температуры нагрева выше 100 °С происходит быстрое объемное расширение ткани за счет кипения тканевой жидкости с образованием газовых пузырей, которые, расширяясь, приводят к механическому разрыву ткани. Этот процесс сопровождается возникновением ультразвуковых колебаний, которые быстро затухают по мере удаления от эпицентра воздействия, но могут приводить к дистантному повреждению тканей, особенно внутри полого органа, к каким относится глазное яблоко.
Дальнейшее увеличение мощности излучения до величин, способных нагреть ткань до температуры 200-300 С, приводит к ее обугливанию, выгоранию и даже к испарению твердых составляющих ткани. Этот эффект обычно обозначают термином «фотоабляция» и используют в офтальмологии достаточно широко, в частности для выжигания небольших, хорошо пигментированных опухолей век и слезного мясца, а также в рефракционной хирургии. Первоначально этот термин использовали для определения испарения с помощью УФ-лазеров, но в широком смысле он характеризует аналогичный эффект немедленного удаления ткани и другими, в частности ИК-лазерами.
Эффект воздействия лазерного излучения на ткань определяется не только длиной волны и мощностью излучения, но и временем, в течение которого при других равных условиях это излучение воздействует на нее, или, другими словами, режимом работы лазера- импульсным, моноимпульсным или непрерывного излучения. Импульсные лазеры, как указывалось выше, генерируют излучение малой фиксированной длительности, поэтому степень нагрева ткани можно регулировать только за счет одного параметра - энергии в импульсе. Но увеличение поглощенной энергии в ткани за столь короткое время сверх определенной величины вследствие, например, естественных колебаний ее в импульсе или более выраженной пигментации в данной точке ткани из-за малой «терапевтической широты» импульсных излучений чревато образованием пара и акустической волны с неизбежным разрывом ткани. Эта особенность импульсных лазеров свободной генерации стала главной причиной практически полного отказа от их использования для целей коагуляции тканей глазного дна.
За еще более короткое время воздействия энергией лазеров (1-10 мДж), работающих в режимах модулированной добротности или синхронизации мод резонатора, при острой фокусировке с углом сходимости 16-18° в фокусе оптической системы (диаметр пятна 10-30 мкм) достигается плотность мощности более 1010 Вт/см. При этом напряженность электрической составляющей излучения превышает 101(1 Вт/см. Это вызывает микролокальный электрический пробой с образованием плазмы. В эпицентре пробоя возникает вторичная мощная, быстро затухающая во времени и пространстве локальная гидродинамическая волна, и избыточное давление достигает значения 103-104, действие которого значительно превышает силу межмолекулярных связей в биоструктурах. Это и является причиной имеющих место локальных, соответствующих размеру диаметра фокального пятна, микрофотодеструкций в глазных тканях в результате действия ультракоротких лазерных импульсов.
Такие лазеры широко используются в офтальмологии для разрушения помутневшей задней капсулы хрусталика, витреоретинальных шварт, иридотомии и других подобных целей.
СОВРЕМЕННЫЕ ОФТАЛЬМОЛОГИЧЕСКИЕ ЛАЗЕРЫ
Среди лазеров, позволяющих коагулировать ткани, в настоящее время по-прежнему наиболее популярными и часто используемыми остаются аргоновые офтальмокоагуляторы (488 и 514 нм), впервые созданные в США в начале 70-х годов. В нашей стране первый такой лазер запатентован и создан в 1982 г. и под названием «Лиман-2» выпускался вплоть до последнего времени на Загорском оптико-механическом заводе. Этот лазер (рис. 134) сыграл большую роль в распространении лазерных методов лечения в России и, хотя морально устарел, еще используется в ряде лечебных учреждений.
За рубежом эти лазеры выпускаются многими фирмами, из которых в России наиболее известны «Carl Zeiss» (Германия) со своей моделью «Visulas Argon» и «Coherent» (США), создавшая универсальную передвижную установку в виде чемодана «Ultima 2000 SE Argon Laser System», которая может быть использована как транспупиллярно, так и эндовитреально в операционном блоке. В последнее время на российский рынок активно выходят японские фирмы, например «Nсlек» со своей моделью аргонового лазера. Серьезным конкурентом аргоновому лазеру становятся в последнее время лазеры с удвоением частоты, позволяющие получать чисто зеленое излучение без синей составляющей (532 нм), что существенно расширяет возможности их использования в макулярной зоне. Наиболее известной из них является модель «ОрМИаШБ 532» фирмы «Асоп» (США). Этот лазер является твердотельным и, соответственно, более портативным и лишенным некоторых недостатков газовых лазеров, он имеет такую же мощность (3 Вт), может использоваться в режиме эндолазера, а также дает возможность получать излучение с длиной волны 1,06 мкм. Накопленный нами опыт применения такого лазера показал его несомненные достоинства.
С конца 80-х годов все более прочные позиции в офтальмологии завоевывают диодные (полупроводниковые) офтальмокоагуляторы (0,81 мкм). Первый российский диодный коагулятор создан нами в 1989 г. и в настоящее время изготавливается в Санкт-Петербурге фирмой «Милон». Этот прибор марки МЛ-200 отличается компактностью и малой массой (4 кг), что позволило полностью изменить идеологию компоновки офтальмокоагуляторов. В нем не офтальмологический прибор, в данном случае щелевая лампа, является дополнением к лазеру, а наоборот, лазер органично вписан в офтальмологический прибор, не увеличивая его габариты (рис. 135). Лазер имеет также блок для эндокоагуляции. Портативность и малая масса прибора важны для военно-полевой офтальмологии, особенно с учетом того, что по мощности (4 Вт) последняя модель лазера даже превосходит аргоновый.

Достоинствами прибора являются также бесшумность работы, высокая надежность из-за отсутствия газовых трубок, ламп накачки и долговечности кристалла полупроводника, на порядок большая по сравнению с газовыми лазерами экономичность. Опыт клинического использования лазера показал, что коагуляция его излучением легче переносится больными, так как оно, будучи невидимым для больного, не обладает слепящим действием, свойственным зеленой части спектра, к которой максимально чувствителен глаз человека. С помощью диодного лазера можно решать практически те же задачи, что и с помощью аргонового, кроме прямой коагуляции сосудов, так как его излучение хуже, чем сине-зеленое, поглощается гемоглобином крови. В то же время он незаменим при лечении различных видов патологии макулярной области сетчатки, так как липофусцин не поглощает его излучение. Диодный офтальмоэндолазер с набором волоконно- оптического инструмента (рис. 136) для транссклеральной и эндофотокоагуляции сетчатки и цилиарного тела марки AJI-6000 в Санкт-Петербурге выпускают совместно фирмы «Медлаз» и «Алком медика». Диодные лазеры выпускаются также зарубежными фирмами «Iris» (США), «Carl Zeiss» (Германия), «Nidek» (Япония), но стоимость этих приборов в 5-7 раз выше.

В среднем и дальнем ИК-В- и ИК-С-диапазонах в России усилиями сотрудников кафедры офтальмологии ВМедА и Государственного оптического института созданы опытные образцы лазеров «Ладога-Неодим» (1,06/1,32 мкм), «Ладога-Эрбий» (1,54 мкм) (рис. 137) и гольмиевого лазера (2,09 мкм), результаты клинических исследований которых обобщены в работах А. Ф. Гацу и соавт., Э. В. Бойко и соавт. В США фирма «Sunrise Technologies» создала Ho.YAG-лазер (2,1 мкм) для термокератопластики и склеро- стомии «Corneal Shaping System» с энергией в импульсе до 300 мДж, но прибор разрешен только в исследовательских целях. В Германии фирма «Aesculap - M?dit?e Gmbh» выпустила на рынок на базе Er:YAG-лазера «VCL-29» две установки- одну для склеростомии, капсулорексиса и факофрагментации и другую- для фотоабляции кожных тканей, которые пока используются в основном для научной работы.

Первый отечественный моноимпульсный рубиновый лазерный фо-тодеструктор «Ятаган» разработки МЭП и производства Ульяновского электролампового завода в настоящее время выпускается в модифицированном варианте «Ятаган-4», выполненном на базе Nd:YAG. На Сергиево-Посадском оптико-механическом заводе выпускается лазерный Nd:YA «Капсула» разработки КБТМ и ГОИ. Фирмы многих развитых стран предлагают большой выбор современных Nd; Y AG-лазеров, используемых в основном для капсуло- и иридотомии.

Это Visulas -YAG фирмы «Carl Zeiss» (рис. 138) в трех модификациях, MQL-12 фирмы «Aesculap» из Германии, Nanolas-15, фирмы «Biophysic medical» из Франции, YAG-3000LE фирмы «Alcon», 7970 Nd: YAG Laser фирмы «Coherent» из США, Iscra-Laser из Словакии и многие другие. Все они имеют длину волны излучения 1,06 мкм, длительность импульса порядка 3~5 не и энергию в импульсе порядка 10 мДж.
Ультрафизиологические (эксимерные) лазеры на флюориде аргона для кэратектомии представляют собой сложные, громоздкие и дорогие компьютеризированные приборы, генерирующие излучение с длиной волны 0,193 мкм с энергией в импульсе около 200 мДж и с частотой повторения импульсов от 1 до 30 Гц. В России первая рефракционная эксимер-лазерная установка создана в МНТК «Микрохирургия глаза» еще в 1988 г. на базе лазера EVG-201 немецкой фирмы «Lambda-Physik».
Она снабжена отечественной оригинальной формирующей системой на основе абсорбционной газовой ячейки, которая позволяет обеспечить плавное изменение рефракции роговицы в любой ее точке. Такие установки работают в Москве и Иркутском филиале МНТК «Микрохирургия глаза». В США только в 1996 г. было получено официальное разрешение FDA (Food and Drug Administration - государственный разрешительный орган) на клиническое применение этих лазеров, которые производятся только рядом компаний, например «Summit Technology» производит лазер Omni-Med, «VISC Inc» - систему 20/20 и т. д. Для европейского потребителя наиболее доступна система MEL-60 фирмы «Aesculap M?dit?e Gmbh» (Германия). Активно внедряется со своей лазерной техникой на русский рынок японская фирма «Nidek», лазеры которой типа ЕС-5000 уже работают в коммерческих лазерных центрах Москвы, Санкт-Петербурга и Челябинска (рис. 139).

Глазной лазерный стимулятор «Монокль» разработки ГОИ, НИИ гигиены труда и профзаболеваний и ВМедА в настоящее время серийно выпускается на Львовском заводе «Полярон». Прибор выполнен в виде бинокулярных очков, к которым через волоконные световоды проводится стимулирующее красное излучение Не-Ие-лазера, размещенного в портативном электронном блоке (см. рис. 145).

Оптотехнический прием, используемый в «Монокле», позволяет создавать по выбору врача различные условия облучения сетчатки каждого глаза - от тотальной до пятен засветки диаметром 4 мм. Предусмотрено индивидуальное варьирование энергетическими параметрами излучения в пятне засветки на сетчатке каждого глаза.
Низкоэнергетические лазерные стимуляторы производятся и реализуются в Санкт-Петербурге. В частности, фирма «Алком-медика» выпускает стимулирующий полупроводниковый лазер АЛ-010 с длиной волны излучения 0,82 мкм мощностью от 5 до 30 мВт, фирма «Медлаз» предлагает гелий-неоновый лазер «Шатл-1» с длиной волны 0,63 мкм мощностью от 2 до 25 мВт, фирма «ВОЛО» разрабатывает и готовит к выпуску полупроводниковый двухволновый портативный аппарат «Латон-100-03» с длиной волн 0,63 и 0,82 мкм.
ПОДГОТОВКА БОЛЬНЫХ К ЛАЗЕРНЫМ ОПЕРАЦИЯМ
Каждом пациенту проводится общепринятое офтальмологическое обследование в объеме, который зависит от диагноза. Идентификация артериальных ветвей при неоваскуляризации роговицы, детальная картина макулярных повреждений могут быть проведены с помощью флюоресцентной ангиографии. Пациент должен быть подробно проинформирован о цели и ожидаемом результате операции, должно быть получено его письменное согласие на операцию.При проведении операции на веках и слезном мясце необходима местная инфильтрационная анестезия. Лазерные операции на глазном яблоке и главном дне, как правило, могут быть сделаны после капельной анестезии 0,25 или 0,5 % раствором дикаина. При необходимости коагуляции тканей глазного дна, при циклокоагуляции и при выраженной светобоязни рекомендуется прибегать к парабульбарной или ретробульбарной анестезии. Лазерная эндокоагуляция в ходе витреоретинальных реконструктивных операций, как правило, требует эндотрахеального наркоза.
При лазерных операциях Nd:УАG-лазером обязательным является исследование исходного уровня внутриглазного давления и контроль его после операции, так как возможен его подъем до 35-50 мм в ранние сроки после операции.
§ "LASER - Light Amplification by Stimulated Emission of Radiation « (усиление света путем стимулированной эмиссии радиации). § Первой отраслью медицины, в которой нашли применение лазеры, была офтальмология. § Лазер (оптический квантовый генератор) - это генератор электромагнитного излучения оптического диапазона, основанный на использовании вынужденного (стимулированного) излучения.
 Свойства лазерного излучения: q. Когерентность q. Монохроматичность q. Большая мощность q. Малая расходимость. Это позволяет избирательно и локально воздействовать на различные биологические ткани.
Свойства лазерного излучения: q. Когерентность q. Монохроматичность q. Большая мощность q. Малая расходимость. Это позволяет избирательно и локально воздействовать на различные биологические ткани.
 Выделяют следующие основные механизмы воздействия лазерного излучения на ткани глаза: ü фотохимический, химических реакций; заключающийся в ускорении ü термический, обеспечивающий коагуляцию белков; ü фотомеханический, вызывающий эффект вскипания воды.
Выделяют следующие основные механизмы воздействия лазерного излучения на ткани глаза: ü фотохимический, химических реакций; заключающийся в ускорении ü термический, обеспечивающий коагуляцию белков; ü фотомеханический, вызывающий эффект вскипания воды.
 Устройство лазера § активная (рабочая) среда; § система накачки (источник энергии); § оптический резонатор (может отсутствовать, если лазер работает в режиме усилителя).
Устройство лазера § активная (рабочая) среда; § система накачки (источник энергии); § оптический резонатор (может отсутствовать, если лазер работает в режиме усилителя).
 Параметры лазерного излучения 1. длина волны: УФ (эксимерный лазер) ИК (диодный, неодимовый, гольмиевый…) работающие в видимом диапазоне (аргоновый) 2. временной режим: импульсные (большинство твердотельных лазеров) – возможно регулировать только энергию в импульсе непрерывного излучения (аргоновый, криптоновый, гелий- неоновый) – изменение мощности и длительности воздействия 3. энергетические параметры мощность лазеров непрерывного излучения измеряется в ваттах, в офтальмологии исп. лазеры до 3 Вт энергетическая эффективность импульсного лазерного излучения измеряется в Дж, в офтальмологии 1 -8 м. Дж
Параметры лазерного излучения 1. длина волны: УФ (эксимерный лазер) ИК (диодный, неодимовый, гольмиевый…) работающие в видимом диапазоне (аргоновый) 2. временной режим: импульсные (большинство твердотельных лазеров) – возможно регулировать только энергию в импульсе непрерывного излучения (аргоновый, криптоновый, гелий- неоновый) – изменение мощности и длительности воздействия 3. энергетические параметры мощность лазеров непрерывного излучения измеряется в ваттах, в офтальмологии исп. лазеры до 3 Вт энергетическая эффективность импульсного лазерного излучения измеряется в Дж, в офтальмологии 1 -8 м. Дж
 Офтальмологические лазеры используют: § аргон, который дает зеленый или зеленовато-голубой свет (488 нм и 514 нм); § криптон, который дает красный или желтый свет (568 нм и 647 нм); § neodymium-yttrium-alluminum-garnet (Nd-YAG), неодимовый лазер на алюмоиттриевом гранате, дает инфракрасный луч (1, 06 мкм). § гелий-неоновый лазер (630 нм); § 10 -углекислотный лазер (10, 6 мкм); § эксимерный лазер (с длиной волны 193 нм); § диодный лазер (810 нм).
Офтальмологические лазеры используют: § аргон, который дает зеленый или зеленовато-голубой свет (488 нм и 514 нм); § криптон, который дает красный или желтый свет (568 нм и 647 нм); § neodymium-yttrium-alluminum-garnet (Nd-YAG), неодимовый лазер на алюмоиттриевом гранате, дает инфракрасный луч (1, 06 мкм). § гелий-неоновый лазер (630 нм); § 10 -углекислотный лазер (10, 6 мкм); § эксимерный лазер (с длиной волны 193 нм); § диодный лазер (810 нм).

 1. Лазеркоагуляция (аргоновый, криптоновый и полупроводниковый диодный лазер). Используют термическое воздействие лазерного излучения при сосудистой патологии глаза: лазеркоагуляция сосудов роговицы, радужки, сетчатки, трабекулопластика, а также воздействие на роговицу ИК-излучением (1, 54 -2, 9 мкм), которое поглощается стромой роговицы, с целью изменения рефракции.
1. Лазеркоагуляция (аргоновый, криптоновый и полупроводниковый диодный лазер). Используют термическое воздействие лазерного излучения при сосудистой патологии глаза: лазеркоагуляция сосудов роговицы, радужки, сетчатки, трабекулопластика, а также воздействие на роговицу ИК-излучением (1, 54 -2, 9 мкм), которое поглощается стромой роговицы, с целью изменения рефракции.
 Аргоновый лазер § Излучает свет в синем и зеленом диапазонах, совпадающий со спектром поглощения гемоглобина, что позволяет эффективно использовать его при лечении сосудистой патологии: диабетической ретинопатии, тромбозах вен сетчатки, ангиоматозе Гиппеля. Линдау, болезни Коатса и др. ; 70% сине-зеленого излучения поглощается меланином и преимущественно используется для воздействия на пигментированные образования.
Аргоновый лазер § Излучает свет в синем и зеленом диапазонах, совпадающий со спектром поглощения гемоглобина, что позволяет эффективно использовать его при лечении сосудистой патологии: диабетической ретинопатии, тромбозах вен сетчатки, ангиоматозе Гиппеля. Линдау, болезни Коатса и др. ; 70% сине-зеленого излучения поглощается меланином и преимущественно используется для воздействия на пигментированные образования.
 Криптоновый лазер § Излучает свет в желтом и красном диапазонах, которые максимально поглощаются пигментным эпителием и сосудистой оболочкой, не вызывая повреждения нервного слоя сетчатки, что важно при коагуляции центральных отделов сетчатки.
Криптоновый лазер § Излучает свет в желтом и красном диапазонах, которые максимально поглощаются пигментным эпителием и сосудистой оболочкой, не вызывая повреждения нервного слоя сетчатки, что важно при коагуляции центральных отделов сетчатки.
 Диодный лазер § Незаменим при лечении различных видов патологии макулярной области сетчатки, так как липофусцин не поглощает его излучение, которое проникает в сосудистую оболочку глаза на большую глубину, чем излучение аргонового и криптонового лазеров. Т. к. излучение происходит в ИКдиапазоне, пациенты не ощущают слепящего эффекта во время коагуляции. Портативный диодный лазер GYC-1000 Nidek
Диодный лазер § Незаменим при лечении различных видов патологии макулярной области сетчатки, так как липофусцин не поглощает его излучение, которое проникает в сосудистую оболочку глаза на большую глубину, чем излучение аргонового и криптонового лазеров. Т. к. излучение происходит в ИКдиапазоне, пациенты не ощущают слепящего эффекта во время коагуляции. Портативный диодный лазер GYC-1000 Nidek
 Видимые лазерные повреждения сетчатки: § Коагулят 1 степени: ватообразный § Коагулят 2 степени: белый, с более четкими границами, § Коагулят 3 степени: белый с резкими границами, § Коагулят 4 степени: ярко-белый, с легкой пигментацией по краю четких границ
Видимые лазерные повреждения сетчатки: § Коагулят 1 степени: ватообразный § Коагулят 2 степени: белый, с более четкими границами, § Коагулят 3 степени: белый с резкими границами, § Коагулят 4 степени: ярко-белый, с легкой пигментацией по краю четких границ

 § 2. Фотодеструкция (фотодисцизия) - YAG-лазер. Благодаря высокой пиковой мощности под действием лазерного излучения происходит рассечение тканей. Вследствие высвобождения большого количества энергии в ограниченном объеме образуется плазма, которая приводит к созданию ударной волны и микроразрыву ткани.
§ 2. Фотодеструкция (фотодисцизия) - YAG-лазер. Благодаря высокой пиковой мощности под действием лазерного излучения происходит рассечение тканей. Вследствие высвобождения большого количества энергии в ограниченном объеме образуется плазма, которая приводит к созданию ударной волны и микроразрыву ткани.
 Nd: YAG-лазер § Неодимовый лазер с излучением в ближнем ИК-диапазоне (1, 06 мкм), работающий в импульсном режиме, является фоторазрушителем, применяется для точных внутриглазных разрезов (рассекание спаек радужки или разрушения спаек стекловидного тела, капсулотомия хрусталика глаза по поводу вторичной катаракты или иридотомия. YC-1800 Nidek Ellex Ultra Q
Nd: YAG-лазер § Неодимовый лазер с излучением в ближнем ИК-диапазоне (1, 06 мкм), работающий в импульсном режиме, является фоторазрушителем, применяется для точных внутриглазных разрезов (рассекание спаек радужки или разрушения спаек стекловидного тела, капсулотомия хрусталика глаза по поводу вторичной катаракты или иридотомия. YC-1800 Nidek Ellex Ultra Q
 § 3. Фотоиспарение и фотоинцизия (СО 2 -лазер). Эффект заключается в длительном тепловом воздействии с испарением ткани. Используется для удаления поверхностных образований конъюнктивы и век.
§ 3. Фотоиспарение и фотоинцизия (СО 2 -лазер). Эффект заключается в длительном тепловом воздействии с испарением ткани. Используется для удаления поверхностных образований конъюнктивы и век.
 4. Фотоабляция (Эксимерные лазеры). § Заключается в дозированном удалении биологических тканей. § Излучают в ультрафиолетовом диапазоне (длина волн - 193 -351 нм). § С помощью этих лазеров можно удалять определенные поверхностные участки ткани с точностью до 500 нм, используя процесс фотоабляции (испарения). § Область использования: рефракционная хирургия, лечение дистрофических изменении роговицы с помутнениями, воспалительные заболевания роговицы, оперативное лечение птеригиума и глаукомы.
4. Фотоабляция (Эксимерные лазеры). § Заключается в дозированном удалении биологических тканей. § Излучают в ультрафиолетовом диапазоне (длина волн - 193 -351 нм). § С помощью этих лазеров можно удалять определенные поверхностные участки ткани с точностью до 500 нм, используя процесс фотоабляции (испарения). § Область использования: рефракционная хирургия, лечение дистрофических изменении роговицы с помутнениями, воспалительные заболевания роговицы, оперативное лечение птеригиума и глаукомы.

 5. Лазерстимуляция (He-Ne-лазеры). § При взаимодействии низкоинтенсивного красного излучения с различными тканями в результате сложных фотохимических процессов проявляются противовоспалительный, десенсибилизирующий, рассасывающий эффекты, а также стимулирующее влияние на процессы репарации и трофики. § Применяется в комплексном лечении увеитов, склеритов, кератитов, экссудативных процессов в передней камере глаза, гемофтальмов, помутнений стекловидного тела, преретинальных кровоизлияний, амблиопий, после операционных вмешательств ожогов, эрозий роговицы, некоторых видах ретино- и макулопатии § Противопоказаниями являются увеиты туберкулезной этиологии, гипертоническая болезнь в стадии обострения, кровоизлияния сроком давности менее 6 дней.
5. Лазерстимуляция (He-Ne-лазеры). § При взаимодействии низкоинтенсивного красного излучения с различными тканями в результате сложных фотохимических процессов проявляются противовоспалительный, десенсибилизирующий, рассасывающий эффекты, а также стимулирующее влияние на процессы репарации и трофики. § Применяется в комплексном лечении увеитов, склеритов, кератитов, экссудативных процессов в передней камере глаза, гемофтальмов, помутнений стекловидного тела, преретинальных кровоизлияний, амблиопий, после операционных вмешательств ожогов, эрозий роговицы, некоторых видах ретино- и макулопатии § Противопоказаниями являются увеиты туберкулезной этиологии, гипертоническая болезнь в стадии обострения, кровоизлияния сроком давности менее 6 дней.

 Лазерное лечение глаукомы направлено на устранение блоков, препятствующих оттоку внутриглазной жидкости в глазу. В настоящее время с этой целью применяют лазеры-коагуляторы, действие которых основано на нанесении на зону трабекулы локального ожога с последующей атрофией и рубцеванием ее ткани (аргоновые лазеры, полупроводниковые (диодные) лазеры) или лазеры-деструкторы (неодимовые ИАГ-лазеры).
Лазерное лечение глаукомы направлено на устранение блоков, препятствующих оттоку внутриглазной жидкости в глазу. В настоящее время с этой целью применяют лазеры-коагуляторы, действие которых основано на нанесении на зону трабекулы локального ожога с последующей атрофией и рубцеванием ее ткани (аргоновые лазеры, полупроводниковые (диодные) лазеры) или лазеры-деструкторы (неодимовые ИАГ-лазеры).

 Консервативное лечение катаракты Применение средств консервативной терапии не ведет к рассасыванию уже имеющихся помутнений в хрусталике, а лишь замедляет их прогрессирование. Лечение начальных стадий возрастной катаракты основано на применении различных глазных капель: квинакс, офтанкатахром, сэнкаталин, витайодурол, витафакол, вицеин, тауфон, капли Смирнова и др. Препараты рекомендуются длительного применения (годами) при различной частоте закапывания (от 2 -3 до 4 -5 раз в течение дня).
Консервативное лечение катаракты Применение средств консервативной терапии не ведет к рассасыванию уже имеющихся помутнений в хрусталике, а лишь замедляет их прогрессирование. Лечение начальных стадий возрастной катаракты основано на применении различных глазных капель: квинакс, офтанкатахром, сэнкаталин, витайодурол, витафакол, вицеин, тауфон, капли Смирнова и др. Препараты рекомендуются длительного применения (годами) при различной частоте закапывания (от 2 -3 до 4 -5 раз в течение дня).
 Методы хирургического лечения § Интракапсулярная экстракция хрусталика – выполняется только при больших подвывихах хрусталика в сочетании с витрэктомией и шовной фиксацией ИОЛ. § Экстракапсулярная экстракция – дешевая устаревшая методика, базовая при проведении операции по системе ОМС. Требует наложения швов. Восстановление зрения происходит в течении нескольких месяцев после операции. Однако, в редких случаях выполняется по медицинским показаниям. § Факоэмульсификация катаракты – основной метод хирургического лечения катаракты.
Методы хирургического лечения § Интракапсулярная экстракция хрусталика – выполняется только при больших подвывихах хрусталика в сочетании с витрэктомией и шовной фиксацией ИОЛ. § Экстракапсулярная экстракция – дешевая устаревшая методика, базовая при проведении операции по системе ОМС. Требует наложения швов. Восстановление зрения происходит в течении нескольких месяцев после операции. Однако, в редких случаях выполняется по медицинским показаниям. § Факоэмульсификация катаракты – основной метод хирургического лечения катаракты.
 Факоэмульсификация катаракты – наиболее безопасный и эффективный метод бесшовного хирургического лечения катаракты. Принципы: § Разрушение вещества хрусталика с помощью ультразвука. § Поддержание постоянного баланса ирригационного и аспирационного потоков жидкостей.
Факоэмульсификация катаракты – наиболее безопасный и эффективный метод бесшовного хирургического лечения катаракты. Принципы: § Разрушение вещества хрусталика с помощью ультразвука. § Поддержание постоянного баланса ирригационного и аспирационного потоков жидкостей.
 Преимущества факоэмульсификации § Малый самогерметизирующийся разрез, не требующий наложения швов – сейчас стандартным в хирургии катаракты считается разрез - 2 мм. § Сведение к минимуму индуцированного астигматизма. § Установка ИОЛ выполняется более быстро и безопасно. § Уменьшение вероятности возникновения геморрагических и воспалительных осложнений. § Достижение высокой остроты зрения в короткие сроки. § Быстрая реабилитация и отсутствие ограничения зрительных нагрузок.
Преимущества факоэмульсификации § Малый самогерметизирующийся разрез, не требующий наложения швов – сейчас стандартным в хирургии катаракты считается разрез - 2 мм. § Сведение к минимуму индуцированного астигматизма. § Установка ИОЛ выполняется более быстро и безопасно. § Уменьшение вероятности возникновения геморрагических и воспалительных осложнений. § Достижение высокой остроты зрения в короткие сроки. § Быстрая реабилитация и отсутствие ограничения зрительных нагрузок.
 Этапы факоэмульсификации § Тоннельный разрез роговицы – 2 мм § Капсулорексис § Гидродиссекция и гидроделинеация (ведение 0. 9 % физиологического раствора или BSS непосредственно под переднюю капсулу хрусталика с целью ее отделения, отделение ядра хрусталика от кортикального слоя). § Удаление ядра хрусталика (факоэмульсификация) § Аспирация остаточных хрусталиковых масс § Имплантация ИОЛ
Этапы факоэмульсификации § Тоннельный разрез роговицы – 2 мм § Капсулорексис § Гидродиссекция и гидроделинеация (ведение 0. 9 % физиологического раствора или BSS непосредственно под переднюю капсулу хрусталика с целью ее отделения, отделение ядра хрусталика от кортикального слоя). § Удаление ядра хрусталика (факоэмульсификация) § Аспирация остаточных хрусталиковых масс § Имплантация ИОЛ


 Использование гибких ИОЛ и инжекторов для имплантации позволило уменьшить операционный разрез сначала до 4, 0 мм, а в настоящее время - до 2, 2 мм. § Применение красителей для передней капсулы хрусталика (0, 5% трепанового синего) сделало возможным выполнение факоэмульсификации при любой степени зрелости катаракты.
Использование гибких ИОЛ и инжекторов для имплантации позволило уменьшить операционный разрез сначала до 4, 0 мм, а в настоящее время - до 2, 2 мм. § Применение красителей для передней капсулы хрусталика (0, 5% трепанового синего) сделало возможным выполнение факоэмульсификации при любой степени зрелости катаракты.
 Классификация ИОЛ: по расположению § Заднекамерные Капсульные Для имплантации в цилиарную борозду Для подшивания в цилиарную борозду § Переднекамерные § ИОЛ зрачковой фиксации
Классификация ИОЛ: по расположению § Заднекамерные Капсульные Для имплантации в цилиарную борозду Для подшивания в цилиарную борозду § Переднекамерные § ИОЛ зрачковой фиксации
 Классификация ИОЛ: по материалу § Жесткие: - ПММА - кристаллические § Гибкие: - силиконовые - акриловые - коллагеновые - гидрогелевые
Классификация ИОЛ: по материалу § Жесткие: - ПММА - кристаллические § Гибкие: - силиконовые - акриловые - коллагеновые - гидрогелевые

 Сравнение качества зрения у пациентов после факоэмульсификации с разными типами ИОЛ Сферическая оптика Асферическая оптика
Сравнение качества зрения у пациентов после факоэмульсификации с разными типами ИОЛ Сферическая оптика Асферическая оптика

 Уход за больными в послеоперационном периоде § После проведенной операции назначают: § дезинфицирующие капли («Витабакт» , «Фурациллин» и др.), § противовоспалительные капли («Наклоф» , «Диклоф» , «Индоколлир») § смешанные препараты (содержат антибиотик + дексаметазон, «Макситрол» , «Тобрадекс» и др.). § Капли назначают по убывающей схеме: первая неделя – 4 -х кратное закапывание, 2 -я неделя – 3 -х кратное закапывание, 3 -я неделя – 2 -х кратное закапывание, 4 -я неделя – однократное закапывание, затем – отмена капель.
Уход за больными в послеоперационном периоде § После проведенной операции назначают: § дезинфицирующие капли («Витабакт» , «Фурациллин» и др.), § противовоспалительные капли («Наклоф» , «Диклоф» , «Индоколлир») § смешанные препараты (содержат антибиотик + дексаметазон, «Макситрол» , «Тобрадекс» и др.). § Капли назначают по убывающей схеме: первая неделя – 4 -х кратное закапывание, 2 -я неделя – 3 -х кратное закапывание, 3 -я неделя – 2 -х кратное закапывание, 4 -я неделя – однократное закапывание, затем – отмена капель.
 Тенденции в развитии хирургии катаракты § Уменьшение разреза 3, 2 – 3, 0 – 2, 75 – 2, 2 – 1, 8 мм § Максимальная безопасность имплантации и биосовместимость материала ИОЛ § Улучшение качества зрения при максимальной ее остроте § Решение проблемы имеющейся аметропии и приобретенной пресбиопии за счет замены хрусталика, т. е. восстановление утраченной аккомодации.
Тенденции в развитии хирургии катаракты § Уменьшение разреза 3, 2 – 3, 0 – 2, 75 – 2, 2 – 1, 8 мм § Максимальная безопасность имплантации и биосовместимость материала ИОЛ § Улучшение качества зрения при максимальной ее остроте § Решение проблемы имеющейся аметропии и приобретенной пресбиопии за счет замены хрусталика, т. е. восстановление утраченной аккомодации.
 Бимануальная факоэмульсификация § Разделение ирригационного и аспирационного потоков § 2 разреза по 1, 2 - 1, 4 мм § Практически нет ИОЛ, которые можно имплантировать через столь малый разрез
Бимануальная факоэмульсификация § Разделение ирригационного и аспирационного потоков § 2 разреза по 1, 2 - 1, 4 мм § Практически нет ИОЛ, которые можно имплантировать через столь малый разрез

 Показания к операции: § Недостаточная эффективность медикаментозного лечения о/у глаукомы (повышенное ВГД, прогрессирующее изменения зрительных функций и ДЗН); § З/у и смешанная глаукома (консервативное лечение имеет вспомогательное значение); § Пациент не может исполнять рекомендации врача по контролю ВГД и зрительных функций; § Не купировавшийся острый приступ глаукомы;
Показания к операции: § Недостаточная эффективность медикаментозного лечения о/у глаукомы (повышенное ВГД, прогрессирующее изменения зрительных функций и ДЗН); § З/у и смешанная глаукома (консервативное лечение имеет вспомогательное значение); § Пациент не может исполнять рекомендации врача по контролю ВГД и зрительных функций; § Не купировавшийся острый приступ глаукомы;
 Основные направления оперативного вмешательства: § Операции, нормализирующие циркуляцию влаги внутри глаза; § Фистулизирующие операции; § Операции, уменьшающие скорость образования влаги; § Лазерные операции.
Основные направления оперативного вмешательства: § Операции, нормализирующие циркуляцию влаги внутри глаза; § Фистулизирующие операции; § Операции, уменьшающие скорость образования влаги; § Лазерные операции.
 Операции, нормализующие циркуляцию влаги: В группу входят операции, устраняющие последствия зрачкового и хрусталикового блоков. § Иридэктомия; § Иридоциклоретракция; § Экстракция хрусталика
Операции, нормализующие циркуляцию влаги: В группу входят операции, устраняющие последствия зрачкового и хрусталикового блоков. § Иридэктомия; § Иридоциклоретракция; § Экстракция хрусталика
 Операции, нормализующие циркуляцию влаги: Иридэктомия. Операция устраняет последствия зрачкового блока, создавая новый путь для движения жидкости из задней камеры в переднюю. В результате выравнивается давления в камерах глаза, исчезает бомбаж радужки и открывается угол передней камеры. Показания: зрачковый блок, з/у глаукома
Операции, нормализующие циркуляцию влаги: Иридэктомия. Операция устраняет последствия зрачкового блока, создавая новый путь для движения жидкости из задней камеры в переднюю. В результате выравнивается давления в камерах глаза, исчезает бомбаж радужки и открывается угол передней камеры. Показания: зрачковый блок, з/у глаукома
 Фистулизирующие операции: § Синустрабекулоэктомия; § Глубокая склерэктомия; § Непроникающая глубокая склерэктомия; § Двухкамерное дренирование После фистулизирующих операций формируется конъюнктивальная фильтрационная подушечка.
Фистулизирующие операции: § Синустрабекулоэктомия; § Глубокая склерэктомия; § Непроникающая глубокая склерэктомия; § Двухкамерное дренирование После фистулизирующих операций формируется конъюнктивальная фильтрационная подушечка.
 Типы фильтрационных подушечек: § Плоская – ВГД в норме или выше нормы, гипотонии обычно не бывает. Коэффициент легкости оттока может быть повышен. § Кистозная – ВГД в норме или нижняя граница нормы, часто бывает гипотония. Характер фильтрационных подушечек зависит от состава и количества внутриглазной жидкости, находящейся в с/конъюнктивальном пространстве, а также индивидуальные особенности соединительной ткани.
Типы фильтрационных подушечек: § Плоская – ВГД в норме или выше нормы, гипотонии обычно не бывает. Коэффициент легкости оттока может быть повышен. § Кистозная – ВГД в норме или нижняя граница нормы, часто бывает гипотония. Характер фильтрационных подушечек зависит от состава и количества внутриглазной жидкости, находящейся в с/конъюнктивальном пространстве, а также индивидуальные особенности соединительной ткани.
 Синустрабекуэктомия: Показания: первичная глаукома, некоторые виды вторичной глаукомы. Принцип операции: субсклерально удаляют участок глубокой пластинки склеры с трабекулой и шлеммовым каналом. Дополнительно производят базальную иридэктомию. Эффективность впервые выполненной операции на ранее не оперированном глазу составляет до 85% в сроки до 2 -х лет. Схема операции трабекулэктомии. 1 -Склеральный лоскут, 2 -удаляемый участок трабекулы, 3 -базальная колобома радужки.
Синустрабекуэктомия: Показания: первичная глаукома, некоторые виды вторичной глаукомы. Принцип операции: субсклерально удаляют участок глубокой пластинки склеры с трабекулой и шлеммовым каналом. Дополнительно производят базальную иридэктомию. Эффективность впервые выполненной операции на ранее не оперированном глазу составляет до 85% в сроки до 2 -х лет. Схема операции трабекулэктомии. 1 -Склеральный лоскут, 2 -удаляемый участок трабекулы, 3 -базальная колобома радужки.
 К отдаленным осложнениям трабекулэктомии относятся: 1. Кистозные изменения фильтрационной подушки; 2. Часто развивается помутнение хрусталика - катаракта.
К отдаленным осложнениям трабекулэктомии относятся: 1. Кистозные изменения фильтрационной подушки; 2. Часто развивается помутнение хрусталика - катаракта.
 Глубокая склерэктомия: Показания: первичная глаукома, некоторые виды вторичной глаукомы. Принцип операции: субсклерально удаляют участок глубокой пластинки склеры с трабекулой и шлеммовым каналом и участком склеры для обнажения части цилиарного тела. Дополнительно производят базальную иридэктомию. Отток влаги идет под конъюнктиву и в супрахориоидальное пространство.
Глубокая склерэктомия: Показания: первичная глаукома, некоторые виды вторичной глаукомы. Принцип операции: субсклерально удаляют участок глубокой пластинки склеры с трабекулой и шлеммовым каналом и участком склеры для обнажения части цилиарного тела. Дополнительно производят базальную иридэктомию. Отток влаги идет под конъюнктиву и в супрахориоидальное пространство.
 Непроникающая ГСЭ: Показания: о/у глаукома с умеренно повышенным ВГД. Принцип операции: под поверхностным склеральным лоскутом иссекают глубокую пластинку склеры с наружной стенкой шлеммова канала и участком корнеосклеральной ткани кпереди от канала. При этом обнажаются вся корнеосклеральная трабекула и периферия десцеметовой оболочки. Преимущества: нет резкого перепада давления во время операции и, следовательно снижен риск осложнений. Фильтрация осуществляется сквозь поры оставшейся трабекулярной сети. После репозиции поверхностного лоскута под ним формируется «склеральное озеро» .
Непроникающая ГСЭ: Показания: о/у глаукома с умеренно повышенным ВГД. Принцип операции: под поверхностным склеральным лоскутом иссекают глубокую пластинку склеры с наружной стенкой шлеммова канала и участком корнеосклеральной ткани кпереди от канала. При этом обнажаются вся корнеосклеральная трабекула и периферия десцеметовой оболочки. Преимущества: нет резкого перепада давления во время операции и, следовательно снижен риск осложнений. Фильтрация осуществляется сквозь поры оставшейся трабекулярной сети. После репозиции поверхностного лоскута под ним формируется «склеральное озеро» .
 Операции, уменьшающие скорость образования влаги: Механизм действия – ожог или отморожение отдельных участков цилиарного тела, либо тромбоз и выключение питающих его сосудов. § Циклокриокоагуляция; § Циклодиатермия. Показания: некоторые виды вторичной глаукомы, терминальная глаукома.
Операции, уменьшающие скорость образования влаги: Механизм действия – ожог или отморожение отдельных участков цилиарного тела, либо тромбоз и выключение питающих его сосудов. § Циклокриокоагуляция; § Циклодиатермия. Показания: некоторые виды вторичной глаукомы, терминальная глаукома.
 Циклокриокоагуляция Это операция, направленная на снижение продукции водянистой влаги ресничным телом. Суть операции заключается в нанесении на поверхность склеры в области проекции цилиарного тела 6 -8 аппликаций специальным криозондом. Цилиарное тело под воздействием низких температур в местах нанесения криокоагулятов атрофируется и в целом начинает продуцировать меньшее количество водянистой влаги.
Циклокриокоагуляция Это операция, направленная на снижение продукции водянистой влаги ресничным телом. Суть операции заключается в нанесении на поверхность склеры в области проекции цилиарного тела 6 -8 аппликаций специальным криозондом. Цилиарное тело под воздействием низких температур в местах нанесения криокоагулятов атрофируется и в целом начинает продуцировать меньшее количество водянистой влаги.
 Лазерные операции: § Используют аргоновые и неодимовые лазеры; § Нет вскрытия фиброзной оболочки; § Нет необходимости в общей или проводниковой анестезии; § Восстановление оттока по естественным каналам; § Возможен реактивный синдром: повышение ВГД, увеит; § Часто необходимо дополнительное медикаментозное гипотензивное лечение; § При прогрессировании глаукомы выраженность лазерного воздествия уменьшается.
Лазерные операции: § Используют аргоновые и неодимовые лазеры; § Нет вскрытия фиброзной оболочки; § Нет необходимости в общей или проводниковой анестезии; § Восстановление оттока по естественным каналам; § Возможен реактивный синдром: повышение ВГД, увеит; § Часто необходимо дополнительное медикаментозное гипотензивное лечение; § При прогрессировании глаукомы выраженность лазерного воздествия уменьшается.
 Методики лазерных операций в лечении глаукомы: § Лазерная иридэктомия § Лазерная трабекулопластика § Лазерная транссклеральная циклофотокоагуляция (контактная и бесконтактная) § Лазерная гониопластика § Лазерная десцеметогониопунктура
Методики лазерных операций в лечении глаукомы: § Лазерная иридэктомия § Лазерная трабекулопластика § Лазерная транссклеральная циклофотокоагуляция (контактная и бесконтактная) § Лазерная гониопластика § Лазерная десцеметогониопунктура
 Преимущества: § Восстановление оттока внутриглазной жидкости по естественным путям; § Не требуется проведение общего обезболивания (достаточно закапывания местного анестетика); § Операция может быть проведена в амбулаторных условиях; § Минимальный период реабилитации; § Отсутствуют осложнения традиционной хирургии глаукомы; § Невысокая стоимость.
Преимущества: § Восстановление оттока внутриглазной жидкости по естественным путям; § Не требуется проведение общего обезболивания (достаточно закапывания местного анестетика); § Операция может быть проведена в амбулаторных условиях; § Минимальный период реабилитации; § Отсутствуют осложнения традиционной хирургии глаукомы; § Невысокая стоимость.
 Недостатки: § Ограниченность эффекта операции, которая снижается по мере увеличения срока, прошедшего с постановки диагноза глаукома; § Возникновение реактивного синдрома, характеризующегося повышением внутриглазного давления в первые часы после лазерного вмешательства и развитием воспалительного процесса в дальнейшем; § Возможность повреждения клеток заднего эпителия роговицы, капсулы хрусталика и сосудов радужки; § Образование синехий в области воздействия (угол передней камеры, зона иридотомии).
Недостатки: § Ограниченность эффекта операции, которая снижается по мере увеличения срока, прошедшего с постановки диагноза глаукома; § Возникновение реактивного синдрома, характеризующегося повышением внутриглазного давления в первые часы после лазерного вмешательства и развитием воспалительного процесса в дальнейшем; § Возможность повреждения клеток заднего эпителия роговицы, капсулы хрусталика и сосудов радужки; § Образование синехий в области воздействия (угол передней камеры, зона иридотомии).
 Предоперационная подготовка больных перед лазерными операциями § 3 -х кратная инстилляция нестероидных противовоспалительных препаратов в течение часа до операции; § Инстилляция препаратов миотического действия за 30 минут до операции; § Инстилляции местных анестетиков перед операцией; § Ретробульбарная анестезия при выраженном болевом синдроме перед операцией.
Предоперационная подготовка больных перед лазерными операциями § 3 -х кратная инстилляция нестероидных противовоспалительных препаратов в течение часа до операции; § Инстилляция препаратов миотического действия за 30 минут до операции; § Инстилляции местных анестетиков перед операцией; § Ретробульбарная анестезия при выраженном болевом синдроме перед операцией.
 Послеоперационная терапия § Инстилляция нестероидных противовоспалительных препаратов 3 - 4 раза в день в течении 5 -7 дней и/или пероральное их применение в течении 3 - 5 дней; § Ингибиторы карбоангидразы (в инстилляциях 7 -10 дней или перорально 3 дня с 3 -х дневным перерывом в течение 3 - 9 дней) ; § Гипотензивная терапия под контролем ВГД. Примечание: § При отсутствии компенсации глаукомного процесса на фоне лазерных вмешательств решается вопрос о хирургическом лечении.
Послеоперационная терапия § Инстилляция нестероидных противовоспалительных препаратов 3 - 4 раза в день в течении 5 -7 дней и/или пероральное их применение в течении 3 - 5 дней; § Ингибиторы карбоангидразы (в инстилляциях 7 -10 дней или перорально 3 дня с 3 -х дневным перерывом в течение 3 - 9 дней) ; § Гипотензивная терапия под контролем ВГД. Примечание: § При отсутствии компенсации глаукомного процесса на фоне лазерных вмешательств решается вопрос о хирургическом лечении.
 Лазерная иридэктомия (иридотомия) - заключается в формировании небольшого отверстия в периферическом отделе радужки. Показания к проведению лазерной иридэктомии: - Профилактика острых приступов глаукомы на парном глазу при положительных нагрузочных пробах и пробе Форбса; - Узкоугольная и закрытоугольная глаукома со зрачковым блоком; - Плоская радужка; - Иридовитреальный блок; - Подвижность иридохрусталиковой диафрагмы при компрессии контактной линзой во время гониоскопии. Противопоказания к проведению лазерной иридэктомии: - Врождённые или приобретённые помутнения роговицы; - Выраженный отек роговицы; - Щелевидная передняя камера; - Паралитический мидриаз.
Лазерная иридэктомия (иридотомия) - заключается в формировании небольшого отверстия в периферическом отделе радужки. Показания к проведению лазерной иридэктомии: - Профилактика острых приступов глаукомы на парном глазу при положительных нагрузочных пробах и пробе Форбса; - Узкоугольная и закрытоугольная глаукома со зрачковым блоком; - Плоская радужка; - Иридовитреальный блок; - Подвижность иридохрусталиковой диафрагмы при компрессии контактной линзой во время гониоскопии. Противопоказания к проведению лазерной иридэктомии: - Врождённые или приобретённые помутнения роговицы; - Выраженный отек роговицы; - Щелевидная передняя камера; - Паралитический мидриаз.
 Лазерная иридэктомия (иридотомия) - заключается в формировании периферическом отделе радужки. небольшого отверстия в Техника проведения: - Операцию проводят под местной анестезией (закапывание раствора лидокаина, инокаина и др.). На глаз устанавливается специальная гониолинза, позволяющая сфокусировать лазерное излучение на выбранный участок радужки. Иридотомия проводится в зоне от 10 до 2 часов с целью избежания светорассеяния после операции. Следует выбирать максимально тонкий участок (крипты) радужки и избегать видимых сосудов. При перфорации радужки визуализируется ток жидкости с пигментом в передней камере. Оптимальный размер иридэктомии 200 -300 мкм. Используемые линзы: - линза Абрахама - линза Вайса
Лазерная иридэктомия (иридотомия) - заключается в формировании периферическом отделе радужки. небольшого отверстия в Техника проведения: - Операцию проводят под местной анестезией (закапывание раствора лидокаина, инокаина и др.). На глаз устанавливается специальная гониолинза, позволяющая сфокусировать лазерное излучение на выбранный участок радужки. Иридотомия проводится в зоне от 10 до 2 часов с целью избежания светорассеяния после операции. Следует выбирать максимально тонкий участок (крипты) радужки и избегать видимых сосудов. При перфорации радужки визуализируется ток жидкости с пигментом в передней камере. Оптимальный размер иридэктомии 200 -300 мкм. Используемые линзы: - линза Абрахама - линза Вайса
 Лазерная трабекулопластика (ЛТП) § Операция заключается в нанесении серии ожогов на внутреннюю поверхность трабекулы. § Операция показана при первичной открытоугольной глаукоме, которая не поддается компенсации с помощью лекарственной терапии. § Это воздействие улучшает проницаемость трабекулярной диафрагмы для водянистой влаги, уменьшает опасность блокады Шлеммова канала. § Механизм действия операции заключается в натяжении и укорочении трабекулярной диафрагмы за счет сморщивания ткани в местах ожогов, а также в расширении трабекулярны
Лазерная трабекулопластика (ЛТП) § Операция заключается в нанесении серии ожогов на внутреннюю поверхность трабекулы. § Операция показана при первичной открытоугольной глаукоме, которая не поддается компенсации с помощью лекарственной терапии. § Это воздействие улучшает проницаемость трабекулярной диафрагмы для водянистой влаги, уменьшает опасность блокады Шлеммова канала. § Механизм действия операции заключается в натяжении и укорочении трабекулярной диафрагмы за счет сморщивания ткани в местах ожогов, а также в расширении трабекулярны
 Лазерная трабекулопластика Техника проведения ЛТП: § Манипуляция выполняется под местной анестезией. На глаз устанавливается специальная гониолинза. Коагуляты наносятся равномерно в передней или средней трети трабекулы на протяжении 120 -180 -270 -300 градусов окружности трабекулы (исключая верхний сектор) за 1 -3 сеанса. При необходимости повторного вмешательства коагуляты наносятся в необработанной зоне. Линзы, используемые для проведения ЛТП: § 3 -х зеркальная линза Гольдмана; § Трабекулопластическая линза Рича; § Гониолинза для селективной ЛТП; § Гониолинза Магна.
Лазерная трабекулопластика Техника проведения ЛТП: § Манипуляция выполняется под местной анестезией. На глаз устанавливается специальная гониолинза. Коагуляты наносятся равномерно в передней или средней трети трабекулы на протяжении 120 -180 -270 -300 градусов окружности трабекулы (исключая верхний сектор) за 1 -3 сеанса. При необходимости повторного вмешательства коагуляты наносятся в необработанной зоне. Линзы, используемые для проведения ЛТП: § 3 -х зеркальная линза Гольдмана; § Трабекулопластическая линза Рича; § Гониолинза для селективной ЛТП; § Гониолинза Магна.
 Транссклеральная циклофотокоагуляция (ТЦФК) В результате коагуляции секретирующего ресничного эпителия, происходит уменьшение продукции водянистой влаги, что приводит к понижению внутриглазного давления. Показания: § Терминальная болящая первичная и вторичная глаукома с высоким ВГД; § Неподдающаяся традиционным способам лечения некомпенсированная первичная глаукома, преимущественно в далекозашедших стадиях; § Длительно существующий реактивный синдром после ранее перенесённых лазерных операций. Противопоказания: § Наличие у пациента хрусталика и хорошее зрение; § Выраженный увеит.
Транссклеральная циклофотокоагуляция (ТЦФК) В результате коагуляции секретирующего ресничного эпителия, происходит уменьшение продукции водянистой влаги, что приводит к понижению внутриглазного давления. Показания: § Терминальная болящая первичная и вторичная глаукома с высоким ВГД; § Неподдающаяся традиционным способам лечения некомпенсированная первичная глаукома, преимущественно в далекозашедших стадиях; § Длительно существующий реактивный синдром после ранее перенесённых лазерных операций. Противопоказания: § Наличие у пациента хрусталика и хорошее зрение; § Выраженный увеит.
 Транссклеральная циклофотокоагуляция (ТЦФК) В результате коагуляции секретирующего ресничного эпителия, происходит уменьшение продукции водянистой влаги, что приводит к понижению внутриглазного давления. Техника проведения ТЦФК: 20 -30 коагулятов наносятся на расстоянии 1, 5 - 3 мм от лимба в зоне проекции отростков цилиарного тела. Примечание: в случаях недостаточного снижения ВГД после ТЦФК возможно повторное ее проведение через 2 - 4 недели, а при «болящей» терминальной глаукоме - через 1 - 2 недели. Параметры лазерного воздействия: § Диодный лазер (810 нм), Nd: YAG-лазер (1064 нм); § Экспозиция = 1 - 5 сек; § Мощность = 0, 8 - 2, 0 Вт;
Транссклеральная циклофотокоагуляция (ТЦФК) В результате коагуляции секретирующего ресничного эпителия, происходит уменьшение продукции водянистой влаги, что приводит к понижению внутриглазного давления. Техника проведения ТЦФК: 20 -30 коагулятов наносятся на расстоянии 1, 5 - 3 мм от лимба в зоне проекции отростков цилиарного тела. Примечание: в случаях недостаточного снижения ВГД после ТЦФК возможно повторное ее проведение через 2 - 4 недели, а при «болящей» терминальной глаукоме - через 1 - 2 недели. Параметры лазерного воздействия: § Диодный лазер (810 нм), Nd: YAG-лазер (1064 нм); § Экспозиция = 1 - 5 сек; § Мощность = 0, 8 - 2, 0 Вт;

 Осложнения ТЦФК: § Хроническая гипотония; § Болевой синдром; § Рубеоз радужки; § Застойная иньекция; § Кератопатия.
Осложнения ТЦФК: § Хроническая гипотония; § Болевой синдром; § Рубеоз радужки; § Застойная иньекция; § Кератопатия.
 Лазерная иридопластика (гониопластика) В области корня радужки наносятся аргон-лазерные коагуляты (от 4 до 10 в каждом квадранте) с исходом в рубец, что приводит к сморщиванию и тракции радужной оболочки, освобождению трабекулярной зоны и расширению профиля угла передней камеры Показания: ЗУГ в случае, когда иридотомия невозможна или неэффективна ОУГ с узким углом как предварительный этап для последующей трабекулопластики Также этот метод используется для создания мидриаза при избыточном миозе (лазерный фотомидриаз). При этом коагуляты наносятся в зрачковой части радужки.
Лазерная иридопластика (гониопластика) В области корня радужки наносятся аргон-лазерные коагуляты (от 4 до 10 в каждом квадранте) с исходом в рубец, что приводит к сморщиванию и тракции радужной оболочки, освобождению трабекулярной зоны и расширению профиля угла передней камеры Показания: ЗУГ в случае, когда иридотомия невозможна или неэффективна ОУГ с узким углом как предварительный этап для последующей трабекулопластики Также этот метод используется для создания мидриаза при избыточном миозе (лазерный фотомидриаз). При этом коагуляты наносятся в зрачковой части радужки.
 Осложнения лазерной гониопластики: § Ирит; § Повреждение эндотелия роговицы; § Повышение ВГД; § Стойкий мидриаз.
Осложнения лазерной гониопластики: § Ирит; § Повреждение эндотелия роговицы; § Повышение ВГД; § Стойкий мидриаз.

Среди лазеров, позволяющих коагулировать ткани, в настоящее время по- прежнему наиболее популярными и часто используемыми остаются аргоновые офтальмокоагуляторы (X = 488 и 514 нм), впервые созданные в США в начале 70-х гг.
В нашей стране первый такой лазер запатентован и создан в 1982 г. и под названием «Лиман-2» выпускался вплоть до последнего времени на Загорском оптико-механическом заводе. Этот лазер (рис. 144) сыграл большую роль в распространении лазерных методов лечения в России и, хотя он морально устарел, но еще используется в ряде лечебных учреждений. За рубежом эти лазеры выпускаются многими фирмами, из которых в России наиболее известны «Carl Zeiss» (Германия) со своей моделью «Visulas Argon» и «Cоherent» (США), создавшая универсальную передвижную установку в виде чемодана «Ultima 2000 SE Argon Laser System», которая может быть использована как транспупиллярно, так и эндовитреально в операционном блоке. В последнее время на российский рынок активно выходят японские фирмы, например «Nidek» со своей моделью аргонового лазера. Серьезным конкурентом аргоновому лазеру стал в последнее время Nd^AG-лазер с удвоением частоты, позволяющий получать чисто зеленое излучение без синей составляющей (X = 532 нм), что существенно расширяет возможности их использования в макулярной зоне. Наиболее известным из них является модель «Ophthalas 532»
Рис. 144. Первый отечественный аргоновый лазер - газовая секция лазерного комплекса «Лиман-2».
фирмы «Alcon» (США). Этот лазер является твердотельным и соответственно более портативным и лишенным некоторых недостатков газовых лазеров, он имеет такую же мощность (3 Вт), может использоваться в режиме эндолазера, а также дает возможность получать излучение с длиной волны 1,06 мкм. Накопленный нами опыт применения такого лазера показал его несомненные достоинства.
«Зеленый» лазер выпускает фирма «Carl Zeiss Meditec», а в России - «Алком-Медика» (СПб.).
С конца 80-х гг. все более прочные позиции в офтальмологии завоевывают диодные (полупроводниковые) офтальмокоагуляторы (X = 0,81 мкм). Первый российский диодный коагулятор создан нами в 1989 г. и в настоящее время изготавливается в Санкт-Петербурге фирмой «Алком-Медика». Этот прибор отличается компактностью и малой массой (4 кг), что позволило полностью изменить идеологию компоновки офтальмокоагуляторов. В нем не офтальмологический прибор, в данном случае щелевая лампа, является дополнением к лазеру, а, наоборот, лазер органично вписан в офтальмологический прибор, не увеличивая его габариты (рис. 145). Лазер имеет также блок для эндокоагуляции. Портативность и малая масса прибора важны для военно-полевой офтальмологии, особенно с учетом того, что по мощности (4 Вт) последняя модель лазера даже превосходит аргоновый. Достоинствами прибора являются также бесшумность работы, высокая надежность из-за отсутствия газовых трубок, ламп накачки и долговечности кристалла полупроводника, на порядок большая по сравнению с газовыми лазерами экономичность. Опыт клинического использования лазера показал, что коагуляция его излучением легче переносится больными, так как оно, будучи невидимым для больного, не

Рис. 145. Первый отечественный диодный лазер МЛ-200 фирмы «Милон».
обладает слепящим действием, свойственным зеленой части спектра, к которой максимально чувствителен глаз человека. С помощью диодного лазера можно решать практически те же задачи, что и с помощью аргонового, кроме прямой коагуляции сосудов, так как его излучение хуже, чем сине-зеленое, поглощается гемоглобином крови. В то же время он незаменим при лечении различных видов патологии макулярной области сетчатки, так как липофусцин не поглощает его излучение . Диодный офтальмоэндолазер с набором волоконно-оптического инструмента (рис. 146) для транссклеральной и эндофотокоагуляции сетчатки и цилиарного тела марки АЛ-6000 в Санкт-Петербурге выпускают совместно фирмы «Медлаз» и «Алком-Медика». Диодные лазеры выпускаются также зарубежными фирмами «Iris» (США), «Carl Zeiss» (Германия), «Nidek» (Япония), но стоимость этих приборов в 5-7 раз выше.
В среднем и дальнем ИК-В- и ИК-С-диапазонах в России усилиями сотрудников кафедры офтальмологии ВМедА и Государственного оптического института созданы опытные образцы лазеров «Ладога-Неодим» (X = 1,06/1,32 мкм), «Ладога-Эрбий» (X = 1,54 мкм) (рис. 147) и гольмиевого лазера (X = 2,09 мкм), результаты клинических исследований которых обобщены в работах А.
Ф. Гацу и соавт., Э. В. Бойко и соавт. . В США фирма «Sunrise Technologies» создала Ho^AG-лазер (X = 2,1 мкм) для термокератопластики и склеростомии «Corneal Shaping System» с энергией в импульсе до 300 мДж, но прибор разрешен только в исследовательских целях. В Германии

Рис. 146. Эндоокулярные и транссклеральные лазерные зонды фирм «Мед- лаз» - «Алком-Медика».

Рис. 147. Иттербий-эрбиевый корнеосклеральный коагулятор.
фирма «Aesculap - Meditec Gmbh» выпустила на рынок на базе EnYAG-лазера «VCL-29» две установки - одну для склеростомии, капсулорексиса и фа- кофрагментации и другую - для фотоабляции кожных тканей. Эти приборы не получили широкого признания и в основном сняты с производства.
Первый отечественный моноимпульсный рубиновый лазерный фотодеструктор «Ятаган» разработки МЭП и производства Ульяновского электролампового завода в настоящее время выпускается в модифицированном варианте «Ятаган-4», выполненном на базе NdAAG-лазера. На Сергиево-Посадском оптико-механическом заводе выпускается лазерный Nd:YAG-фотодеструктор «Капсула» разработки КБТМ и ГОИ. Фирмы многих развитых стран предлагают большой выбор современных Nd^AG-лазеров, используемых в основном для капсуло- и иридотомии. Это Visuhs -YAG фирмы «Carl Zeiss» (рис. 148) в трех модификациях, MQL-12 фирмы «Aesculap» из Германии, Nanolas-15, фирмы «Biophysic medical» из Франции, YAG-3000LE фирмы «Alcon», 7970 Nd: YAG Laser фирмы «Coherent» из США, Iscra-Laser из Словакии и многие другие. Все они имеют длину волны излучения 1,06 мкм, длительность импульса порядка 3-5 нс и энергию в импульсе порядка 10 мДж.
Ультрафиолетовые (эксимерные) лазеры на флюориде аргона (ArF) для ке- ратэктомии представляют собой сложные, громоздкие и дорогие (ценой $250 000 и более) компьютеризированные приборы, генерирующие излучение с длиной волны 0,193 мкм с энергией в импульсе около 200 мДж и с частотой повторения импульсов 250 Гц. В России первая рефракционная эксимер-лазерная установка создана в МНТК «Микрохирургия глаза» еще в 1988 г. на базе лазера EVG-201 немецкой фирмы «Lambda-Physik». Она снабжена отечественной оригинальной формирующей системой на основе абсорбционной газовой ячейки, которая позволяет обеспечить плавное изменение рефракции роговицы в любой ее точке. В настоящее время выпускается отечественный эксимерный лазер «Микроскан» с формирующей системой типа летающего пятна. В США только в 1996 г. было получено официальное разрешение FDA (Food and Drug Administration - государственный разрешительный орган) на клиническое применение этих лазеров, которые производятся сейчас рядом компаний. Для европейского потребителя наиболее доступна система MEL-80 фирмы «Carl Zeiss Meditec» (Германия). Активно внедрилась со своей лазерной техникой на русский рынок японская фирма «Nidek», лазеры которой типа ЕС-5000 работают в коммерческих лазерных центрах Москвы, Санкт-Петербурга, Челябинска и др. городов (рис. 149).
Глазной лазерный стимулятор «Монокль» разработки ГОИ, НИИ гигиены труда и профзаболеваний и ВМедА в настоящее время серийно выпускается на львовском заводе «Полярон» . Прибор выполнен в виде бинокулярных очков, к которым через волоконные световоды проводится стимулирующее красное излучение He-Ne-лазера, размещенного в портативном электронном блоке (см. рис. 145). Оптотехнический прием, используемый в «Монокле», позволяет создавать по выбору врача различные условия облучения сетчатки каждого глаза - от тотальной до пятен засветки диаметром 4 мм. Предусмотрено индивидуальное варьирование энергетическими параметрами излучения в пятне засветки на сетчатке каждого глаза.
Низкоэнергетические лазерные стимуляторы производятся и реализуются в Санкт-Петербурге. В частности, фирма «Алком-Медика» выпускает стиму-

Рис. 148. Visulas-YAG - моноимпульсный лазер фирмы «Carl Zeiss».
фото с сайта doktorlaser.ru
Офтальмология раньше других отраслей медицины освоила технологию усиления света с помощью вынужденного излучения. В лечении болезней зрения применяют лазерные системы разного типа с различной активной средой (источником излучения), длиной волны, биологическим и терапевтическим эффектом.
1. Эксимерные: генерируют излучение в ультрафиолетовом диапазоне 193–351 нм; предназначены для фотоабляции (испарения) локальных поверхностных участков ткани с высокой точностью. Незаменимы в рефракционной хирургия, в борьбе с дистрофическими изменениями и воспалениями роговицы, глаукомой.
2. Аргоновые: действуют в диапазонах синем и зелёном, 488 нм и 514 нм; эффективны в терапии сосудистых патологий: тромбозов вен сетчатки, болезни Коатса, ретинопатии.
3. Криптоновые: жёлтый-красный диапазоны, 568 нм и 647 нм; полезны при коагуляции центральных долей сетчатки.
4. Диодные: инфракрасный диапазон на длине волны 810 нм; за счёт глубокого проникновения в сосудистую оболочку эффективны при патологиях макулярных участков сетчатки.
5. ND:YAG - неодимовые на алюмоиттриевом гранате: действуют импульсно, в ближнем ИК-диапазоне (532 нм); подходят для выполнения точных микроразрезов, иссечения вторичных катаракт. Полноценно заменяют аргоновый лазер в микрохирургии макулярной области.
6. Гелий-неоновые (He-Ne , 630 нм): непрерывно действующие низкоэнергетические системы, оказывающие на ткани мощное биостимулирующее действие с противовоспалительным, десенсибилизирующим, рассасывающим и регенерирующим эффектами.
7. 10-углекислотные инфракрасные (10,6 мкм) предназначены для испарения тканей, удаления разрастаний в области конъюнктивы, век.
Сегодня в каждой офтальмологической клинике расскажут подробно о восстановлении зрения лазером. Сочетание высокой мощности, энергетической насыщенности, регулируемого термического эффекта делают возможным применение этого оборудования в хирургии, терапии, диагностике.
Хирургия:
1. Термическая коагуляция сосудов, «спаивание» тканей.
2. Фотодеструкция (малотравматичное рассечение тканей).
3. Фотоиспарение (длительное тепловое воздействие).
4. Фотоабляция (локализованное удаление участков тканей).
Лазерная диагностика:
1. Процедура интерферометрии помогает установить ретинальную точность зрения при мутности глазной среды, часто перед хирургическим удалением катаракты.
2. Офтальмоскопия - сканирование сетчатки без предварительного расширения зрачка.
3. Допплеровское измерение скорости движения крови в сосудах сетчатки.
Терапия: низкоинтенсивная лазерная стимуляция как физиотерапевтический метод показана при многих офтальмологических патологиях: склеритах, экссудативных процессах, кератитах, увеитах, помутнениях стекловидного тела.