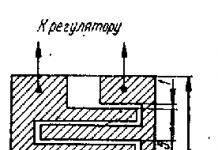
Почка является парным органом, выполняющим функцию мочеобразования, регуляцию артериального давления, минерального обмена и кроветворения.
Закладка почек у плода происходит уже на 4-5 неделях беременности.
При наличии дефекта гена, ответственного за синтез коллагена четвертого типа, страдает сосудистая система почек, капсула хрусталика, кортиев орган (находится в области внутреннего уха).
Данное наследственное заболевание получило название синдром Альпорта.
Причины возникновения наследственного заболевания у детей
 Синдром Альпорта также называется наследственным воспалением почек. Встречается как у мальчиков, так и у девочек. Выявляется патология при прохождении профилактических осмотров.
Синдром Альпорта также называется наследственным воспалением почек. Встречается как у мальчиков, так и у девочек. Выявляется патология при прохождении профилактических осмотров.
Заболевание обусловлено генетическим дефектом структуры белка. К провоцирующим факторам, которые приводят к мутации гена, относятся:
- Перенесенное инфекционное заболевание матери в период беременности. Особенно опасна инфекция в первом триместре, когда происходит закладка органов и тканей плода.
- Вакцинация, проведенная беременной женщине.
- Чрезмерная физическая нагрузка и эмоциональный стресс, постоянно сопровождающие будущую маму.
Виды синдрома
 Выделяют следующие генетические формы синдрома Альпорта:
Выделяют следующие генетические формы синдрома Альпорта:
- Х-сцепленную доминантную, или классическую (восемьдесят процентов с СА);
- аутосомно-рецессивную (пятнадцать процентов пациентов);
- аутосомно-доминантную (пять процентов с СА).
Клиническая классификация основана на проявлениях данной наследственной патологии:
- Сочетанное поражение почек (нефрит и ), глаз, внутреннего уха. Соответствует Х-доминантной форме синдрома Альпорта.
- Поражение почек ( , сопровождающийся гематурией) без структурных нарушений в органах чувств. Так проявляется аутосомно-рецессивная форма заболевания.
- Семейная гематурия, которая носит доброкачественный характер.
При первых двух вариантах развивается почечная недостаточность. В третьем случае заболевание не влияет на продолжительность жизни и ее качество.
Проявление клинической картины
 Врач и родители могут обратить внимание на следующие признаки:
Врач и родители могут обратить внимание на следующие признаки:
- нарушение зрения;
- снижение слуха или глухоту;
- отставание в развитии.
Ребенок старшего возраста может жаловаться на бессонницу, головную боль, головокружение, утомляемость даже после небольшой физической активности, что и может быть симптоматикой синдрома Альпорта.
Артериальное давление у этих детей понижено, что выявляется на профилактических осмотрах.
Стадии течения
Течение заболевания зависит от его клинического варианта:
- при поражении почек, зрения и внутреннего уха патология прогрессирует быстро, приводит к развитию почечной недостаточности, дальнейшему снижению зрительной и слуховой функций;
- нефрит, сопровождающийся (), также со временем приведет к снижению выделительной ;
- доброкачественная семейная гематурия не приводит к жизненно опасным осложнениям.
Диагностические меры
Диагноз выставляется на основании жалоб, объективного, лабораторно-инструментального, морфологического и генетического исследования.
Родители обращают внимание на изменение окраски мочи ребенка, его быструю утомляемость, плохую переносимость физических нагрузок.
Врач выявляет снижение зрения и слуха, пониженное артериальное давление.
Лабораторные исследования
 Ребенку назначается:
Ребенку назначается:
- общий анализ крови и мочи;
- биохимический анализ крови ( , электролиты).
В общем анализе крови наблюдается снижение количества эритроцитов и гемоглобина, что говорит об анемии.
Анемия связана со снижением выработки в почках эритропоэтина. Эритропоэтин является стимулятором кровообразования.
В общем анализе мочи обнаруживается белок (протеинурия) и эритроциты (гематурия). При развитии недостаточности почек снижается плотность и количество суточной мочи.
Показатели креатинина и мочевины отображают выделительную способность органа. При наличии стойкого увеличения этих показателей выставляется степень почечной недостаточности.
Инструментальный способ
Детям выполняется ультразвуковое и рентгенографическое исследование брюшной полости, на которых выявляются характерные изменения.
В обязательном порядке ребенок должен пройти аудиометрию, офтальмоскопию, чтобы выявить снижение слуховой и зрительной функции на ранней стадии.
Морфологическая проверка
Является наиболее ценным в диагностике синдрома Альпорта. Биопсия представляет собой прижизненное исследование тканей. Морфолог описывает особенности строения коркового и мозгового вещества почек, а также сосудистую сеть органа.
Генетическое распознавание
Дорогостоящий метод диагностики. Позволяет выявить дефектный ген, который отвечает за синтез патологического белка.
К кому обратиться
При появлении первых признаков болезни (кровь в моче, снижение слуха и зрения у ребенка) следует обратиться к педиатру.
Педиатр назначит дополнительные методы обследования, после которых может понадобиться консультация , офтальмолога, лора и генетика.
Методы терапии
 Лечение синдрома Альпорта включает в себя диету, прием лекарственных средств, своевременную санацию очагов инфекции.
Лечение синдрома Альпорта включает в себя диету, прием лекарственных средств, своевременную санацию очагов инфекции.
Прививки детям противопоказаны, вакцинация возможна только при наличии строгих показаний.
На данный момент не существует фармакологических препаратов, которые бы воздействовали на генетический дефект.
Широко применяют метаболические препараты, которые позволяют повысить . К ним относятся кокарбоксилаза, витамины А, Е, В6. При появлении белка в моче назначаются нефропротекторы (препараты, защищающие почки).
К ним относятся ингибиторы ангиотензинпревращающего фермента (эналаприл, лизиноприл, рамиприл, пириндоприл) и блокаторы ангиотензиновых рецепторов (лозартан).
Вышеперечисленные препараты относятся к группе гипотензивных средств.
Даже при пониженном артериальном давлении у детей, следует принимать минимальные дозы лекарств, чтобы снизить скорость прогрессии недостаточности почек.
Физическая активность
Ребенок с синдромом Альпорта должен воздерживаться от тяжелых физических нагрузок. Однако ему необходимы ежедневные пешие прогулки не менее 40 минут.
Это позволит улучшить микроциркуляцию в почках, а также будет способствовать нормальному развитию.
Диетические предписания
Следует исключить из рациона:
- соленую, жирную и копченую пищу;
- рряности и острую еду;
- рродукты с высоким содержанием искусственных красителей.
Необходимо следить за количеством поступления белка в организм, при развитии почечной недостаточности жидкость ограничить до одного литра, соль до одного грамма в сутки.
С пищей должно поступать достаточное количество калорий, витаминов, макро- и микроэлементов.
Хирургическое вмешательство
 На , при которых почки не справляются с выделением токсических продуктов обмена веществ, проводится и пересадка почки.
На , при которых почки не справляются с выделением токсических продуктов обмена веществ, проводится и пересадка почки.
Гемодиализ выполняется аппаратом « » почка. Суть процедуры заключается в очищении крови пациента от токсических веществ, является жизненно необходимой.
Также пациенту выполняется пересадка почки, после которой назначается иммуносупрессивная терапия для профилактики отторжения трансплантата.
Народная медицина
 Применяется совместно с традиционными способами после консультации с лечащим врачом. Используются свойства лекарственных растений, помогающие облегчить клинические проявления заболевания.
Применяется совместно с традиционными способами после консультации с лечащим врачом. Используются свойства лекарственных растений, помогающие облегчить клинические проявления заболевания.
Для улучшения микроциркуляции в почках можно употреблять неконцентрированные и .
Увеличить скорость клубочковой фильтрации поможет , плоды можжевельника, почки березы.
Осложнения и последствия
Наиболее грозным осложнением является почечная недостаточность. О ней свидетельствуют повышение таких показателей, как мочевина и креатинин, снижение скорости клубочковой фильтрации.
На начальных этапах почечной недостаточности рекомендовано соблюдение диеты, употребление лекарственных средств, на поздних – гемодиализ и .
При потере слуха и зрения проводится хирургическое вмешательство. Показания для него выставляют лор и офтальмолог.
Прогноз и профилактика
Неблагоприятный прогноз наиболее вероятен для ребенка мужского пола, а также при наличии:
- высокой концентрации белка в общем анализе мочи;
- раннего развития почечных нарушений у близких родственников;
- тугоухости.
Если выявлена изолированная гематурия без сопутствующей протеинурии и снижения слуха прогноз заболевания благоприятный, функциональная недостаточность почек развивается редко.
К профилактическим мерам относится планирование беременности (санация хронических очагов инфекции, женщина должна избегать чрезмерных физических и эмоциональных нагрузок, своевременно стать на учет в женскую консультацию, при наличии показаний пройти медико-генетическое консультирование).
Ребенку необходимо проходить регулярные профилактические осмотры у педиатра. При обнаружении первых признаков болезни, родители должны сообщить врачу.
Синдром Альпорта – тяжелое генетически обусловленное заболевание почек, зрительного и слухового аппарата. При своевременной постановке диагноза и соблюдению рекомендаций, можно замедлить темпы развития почечной недостаточности, тугоухости.
Синдром Альпорта (нефрит наследственный) встречается редко. Эта патология провоцирует нарушение зрения и потерю слуха. Нередко это ведет к потребности в пересадке почки.
Этот синдром проявляется в 3–5 лет. Наследственный нефрит у детей постоянно прогрессирует. Параллельно ребенок теряет слух и зрение, поражается клубочковый аппарат почек.
Развивается синдром Альпорта из-за мутации гена, вырабатывающего коллаген. Эта разновидность коллагена участвует в построении капсулы хрусталика и части внутреннего уха. Отсюда нарушения их функции, а также нарушаются функции самих почек.
Согласно международной классификации эта патология относится к врожденным аномалиям, хромосомным нарушениям и деформациям. Она считается врожденным пороком, так как страдает сразу несколько органов и систем.
Причины патологических изменений
Основная причина синдрома Альпорта – мутация генов.
Пострадавший ген в большинстве случаев передается от одного из родителей. Если в роду кто-то страдал болезнью мочевыделительной системы, вероятность патологии существенно увеличивается.
В 20% всех случаев случается спонтанная мутация генов. Это значит, что у совершенно здоровых родителей гарантированно появится ребенок с подобной патологией.
Симптоматика
Коллаген – важнейшая составляющая соединительной ткани. Его недостаток провоцирует изменения в базальных мембранах почечных клубочков, глазном аппарате и внутреннем ухе. Эти органы перестают справляться со своими функциями.
Симптомы этой патологии делят на два основных вида:
- почечные (кровь и в моче);
- непочечные.
Почечные проявления еще называют изолированным мочевым синдромом.

Он проявляется не сразу после рождения, а ближе к 3–5 годам. Известны случаи, когда патология обнаруживалась значительно позже в возрасте 7–9 лет. Но всегда в моче есть крошечные капли крови. Поначалу их просто больные могут не заметить ().
При этой патологии важно вовремя поставить правильный диагноз, убрать физические нагрузки, обеспечить строгую диету, регулярное комплексное лечение. Большую роль играет правильный образ жизни. Родителям не следует паниковать, ведь современная медицина в состоянии помочь даже при таком генетическом отклонении, как синдром Альпорта. Болезнь передается по наследству, поэтому необходимо предпринимать лечебные меры в отношении всех членов семьи, у которых появилась симптоматика.
Синдром Альпорта являет собой наследственное заболевание, которое проявляется ранним развитием почечной недостаточности, снижением остроты слуха и зрения.
Болезнь обусловлена генетическими мутациями, затрагивающими соединительную ткань – коллаген 4 типа, который является составляющей частью многих важных структур организма, в том числе почек, внутреннего уха и глаз.
Синдром Альпорта намного тяжелее переносится представителями мужского пола. Дело в том, что заболевание чаще всего передается через мутированную Х-хромосому. Так как у девочек две Х-хромосомы, то здоровая срабатывает в качестве запасной и облегчает течение болезни.
При синдроме Альпорта из-за неспособности почек устранять токсины возникает отравление организма. Поэтому у представительниц женского пола эта патология может вызывать бесплодие. А если беременность и наступает, токсины могут погубить и ребенка, и мать. Часто синдром Альпорта проявляется именно во время беременности, если даже ранее не давал о себе знать.
Симптоматика заболевания
Как говорит о таком недуге как синдром Альпорта Википедия, эта наследственная болезнь характеризируется гематурией (кровью в моче), лейкоцитурией (выявление лейкоцитов в анализе мочи), протеинурией (наличие белка в моче), глухотой или тугоухостью, иногда катарактой и развитием почечной недостаточности в подростковом возрасте. Иногда поражение почек может проявляться только после 40-50 лет.
Основной симптом недуга – это наличие крови в моче, что указывает на заболевание почек. Иногда ее можно выявить лишь микроскопически, а в некоторых случаях моча может становиться розовой, коричневой или красной, особенно на фоне подсоединившихся инфекций, гриппа или вирусов в организме. С возрастом кроме гематурии в моче появляется белок и у больного наблюдается артериальная гипертензия.
Хотя синдром Альпорта Википедия описывает как болезнь, которая проявляется катарактой, это не всегда так. Иногда также может возникать аномальная пигментация сетчатки, что значительно ухудшает зрение. Кроме этого, роговица при таком наследственном недуге склонна к развитию эрозий. Потому им нужно беречь глаза от попадания у них инородных предметов.
Синдром Альпорта характеризирует также потеря слуха, которая обычно проявляется в подростковом периоде. Эта проблема решается с помощью слухового аппарата.
Синдром Альпорта: лечение и профилактика
Синдром Альпорта, лечение которого в основном симптоматическое, предполагает обязательную санацию хронических очагов инфекций. Пациентам с этим заболеванием противопоказано проводить прививки в спокойное от эпидемий время. Также имеются противопоказания к приему глюкокортикоидных лекарственных препаратов. При почечной недостаточности применяют диализ, а ее развитие после 20-летнего возраста – это показание для трансплантации почек.
Относительно профилактики патологии, то следует беречься от инфекций мочеполовых путей, которые ускоряют развитие почечной недостаточности. Женщинам с синдромом Альпорта, решившим родить ребенка, необходимо предварительно проконсультироваться с генетиком, который поможет выявить носителя мутантного гена. Хотя статистика показывает, что у около 20% семей, столкнувшихся с синдромом Альпорта, нет родственников, страдающих почечной недостаточностью. Этот факт доказывает, что мутированный ген может возникать спонтанно.
Чтобы уберечь своих потомков от такого наследственного недуга как синдром Альпорта, необходимо избегать родственных браков. А если носитель аномального гена выявлен, чтобы искоренить патологию в будущем, можно воспользоваться донорским генетическим материалом и прибегнуть к процедуре инсеминации или искусственного оплодотворения. В каждом отдельном случае необходима индивидуальная консультация специалистов.
Наследственный нефрит (синдром Альпорта) - генетически детерминированная наследственная неиммунная гломерулопатия, проявляющая гематурией (иногда с протеинурией), прогрессирующим снижением почечных функций с развитием хронической почечной недостаточности, часто сочетающаяся с нейросенсорной глухотой и расстройствами зрения.
Впервые заболевание описано в 1902 г. L.G.Guthrie, который наблюда семью, в нескольких поколениях которой наблюдалась гематурия. В 1915 у членов этой же семьи A.F.Hurst было описано развитие уремии. В 1927 г. A Alport впервые выявил тугоухость у нескольких родственников с гематурией В 50-е годы прошлого века были описаны поражения глаз при подобном заболевании. В 1972 г. у больных с наследственной гематурией при морфологически исследовании почечной ткани Hinglais et al. выявили неравномерное расширение и расслоение гломерулярных базальных мембран. В 1985 г. была идентифицирована генетическая основа наследственного нефрита - мутация в гене коллагена IV типа (Fiengold et al., 1985).
Исследование генетической природы заболевания позволило заключить, что различия в фенотипических проявлениях наследственного нефрита (с тугоухостью или без нее) обусловлены степенью экспрессии мутантного гена. Таким образом, в настоящее время все клинические варианты рассматриваются как проявления одного заболевания и термин "наследственный нефрит" является синонимом термина "синдром Альпорта".
Согласно данным эпидемиологических исследований наследственный нефрит встречается с частотой 17 на 100 000 детского населения.
, , , , , ,
Код по МКБ-10
Q87.8 Другие уточненные синдромы врожденных аномалий, не классифицированные в других рубриках
Причины синдрома Альпорта
Генетическая основа болезни - мутация в гене а-5 цепи коллагена IV типа. Этот тип универсален для базальных мембран почки, кохлеарного аппарата, капсулы хрусталика, сетчатки и роговицы глаза, что доказано в исследованиях с использованием моноклональных антител против этой фракции коллагена. В последнее время указывают на возможность применения ДНК-зондов для пренатальной диагностики наследственного нефрита.
Подчеркивается важность тестирования всех членов семьи с помощью ДНК-зондов для выявления носителей мутантного гена, что имеет большое значение при проведении медико-генетического консультирования семей с этим заболеванием. Однако до 20% семей не имеют родственников, страдающих болезнью почек, что позволяет предполагать высокую частоту спонтанных мутаций аномального гена. У большинства больных наследственным нефритом в семьях имеются лица с почечными заболеваниями, снижением слуха и патологией зрения; имеют значение родственные браки между людьми, имеющими одного или более предков, так как в браке родственных особей возрастает вероятность получения одинаковых генов со стороны обоих родителей. Установлены аутосомно-доминантный и аутосомно-рецессивный и доминантный, сцепленный с Х-хромосомой пути передачи.
У детей чаще различают три варианта наследственного нефрита: синдром Альпорта, наследственный нефрит без тугоухости и семейная доброкачественная гематурия.
Синдром Альпорта - наследственный нефрит с поражением слуха. В основе лежит сочетанный дефект структуры колагена базальной мембраны клубочков почек, структур уха и глаза. Ген классического синдрома Альпорта расположен в локусе 21-22 q длинного плеча Х-хромосомы. В большинстве случаев наследуется по доминантному типу, сцепленному с Х-хромосомой. В связи с этим у мужчин синдром Альпорта протекает тяжелее, так как у женщин функция мутантного гена компенсируется здоровым аллелем второй, неповрежденной хромосомы.
Генетической основой развития наследственного нефрита являются мутации в генах альфа-цепей коллагена IV типа. Известно шесть а-цепей IV коллагена Г типа: гены а5- и а6-цепей (Соl4A5 и Соl4A5) находятся на длинном плече Х-хромосомы в зоне 21-22q; гены а3- и а4-цепей (Соl4A3 и Соl4A4) - на 2-й хромосоме; гены a1- и a2-цепей (Соl4A1 и Соl4A2) - на 13-й хромосоме.
В большинстве случаев (80-85%) выявляется Х-сцепленный тип наследования заболевания, связанный с повреждениями гена Соl4A5 в результате делеции, точечных мутаций или нарушений сплайсинга. В настоящее время найдено более 200 мутаций гена Соl4A5, ответственных за нарушение синтеза а5-цепей коллагена IV типа. При этом типе наследования заболевание проявляется у детей обоего пола, но у мальчиков протекает тяжелее.
Мутации в локусах генов Соl4A3 и Соl4A4, ответственных за синтез а3- и а4 - цепей коллагена IV типа, наследуются аутосомно. По данным исследований аутосомно-доминантныи тип наследования отмечается в 16% случаев наследственного нефрита, аутосомно-рецессивный - у 6% больных. Изестно около 10 вариантов мутаций генов Соl4A3 и Соl4A4.
Результатом мутаций является нарушение процессов сборки коллагена IV типа, приводящее к нарушению его структуры. Коллаген IV типа является одним из основных компонентов гломерулярной базальной мембраны, кохлеарного аппарата и хрусталика глаза, патология которых будет выявляться в клинике наследственного нефрита.
Коллаген IV типа, входящий в состав гломерулярной базальной мембраны, состоит в основном из двух а1-цепей (IV) и одной а2-цепи (IV), а также содержит а3, а4, а5-цепи. Наиболее часто при Х-сцепленном наследовании мутация гена Соl4A5 сопровождается отсутствием а3-, а4-, а5- и а6 цепей в структуре коллагена IV типа, а количество о1- и а2-цепей в гломерулярной базальной мембране возрастает. Механизм этого феномена неясен, предполагается, что причиной являются посттранскрипционные изменения мРНК.
Отсутствие а3-, а4- и а5-цепей в структуре IV типа коллагена базальных мембран клубочков приводит к их истончению и ломкости на ранних стадиях синдрома Альпорта, что клинически проявляется чаще гематурией (реже гематурией с протеинурией или только протеинурией), снижением слуха и лентиконусом. Дальнейшее прогрессирование заболевания приводит к утолщению и нарушению проницаемости базальных мембран на поздних стадиях заболевания, с разрастанием в них коллагена V и VI типов, проявляющихся в нарастании протеинурии и снижении почечных функций.
Характер мутации, лежащей в основе наследственного нефрита, во многом определяет его фенотипическое проявление. При делеции Х-хромосомы с одновременной мутацией генов Соl4A5 и Соl4A6, ответственных за синтез а5- и а6-цепей коллагена IV типа, синдром Альпорта сочетается с лейомиоматозом пищевода и половых органов. По данным исследований при мутации гена Соl4A5, связанной с делецией, отмечаются большая тяжесть патологического процесса, сочетание почечного поражения с экстраренальными проявлениями и ранним развитием хронической почечной недостаточности, по сравнению сточечной мутацией этого гена.
Морфологически при электронной микроскопии выявляется истончение и расслоение гломерулярных базальных мембран (особенно lamina densa) и наличие электронно-плотных гранул. Поражение гломерул может быть неоднородным у одного и того же больного, от минимального фокального поражения мезангия до гломерулосклероза. Гломерулит при синдроме Альпорта всегда носит иммунонегативный характер, что отличает его от гломерулонефрита. Характерны развитие атрофии канальцев, лимфогистиоцитарная инфильтрация, наличие "пенистых клеток" с включениями липидов - липофагами. При прогрессировании заболевания выявляется утолщение и выраженная деструкция базальных мембран клубочков.
Выявляются определенные сдвиги в состоянии имунной системы. У больных наследственным нефритом отмечено снижение уровня Ig A и склонность к повышению концентрации IgМ в крови, уровень IgG может быть повышен на ранних стадиях развития заболевания и снижаться на поздних сроках. Возможно, повышение концентрации IgM и G является своеобразной компенсаторной реакцией в ответ на дефицит IgA.
Функциональная активность системы Т-лимфоцитов снижена; отмечается избирательное снижение В-лимфоцитов, ответственных за синтез Ig A, нарушается фагоцитарное звено иммунитета, в основном за счет нарушения процессов хемотаксиса и внутриклеточного переваривания в нейтрофилах
При исследовании биоптата почек у больных с синдромом Альпорта по данным электронной микроскопии наблюдаются ультраструктурные изменения базальной мембраны клубочка: истончение, нарушение структуры и расщепление гломерулярных базальных мембран с изменением ее толщины и неравномерностью контуров. На ранних стадиях наследственного нефрита дефект определяет истончение и ломкость гломерулярных базальных мембран.
Истончение гломерулярных мембран является более благоприятным признаком и чаще встречается у девочек. Более постоянный электронно-микроскопический признак при наследственном нефрите - расщепление базальной мембраны, причем выраженность деструкции ее коррелирует с тяжестью процесса.
Симптомы синдрома Альпорта у детей
Первые симптомы синдрома Альпорта в виде изолированного мочевого синдрома чаще выявляются у детей первых трех лет жизни. В большинстве случаев заболевание обнаруживается случайно. Мочевой синдром выявляется при профилактическом обследовании ребенка, перед поступлением в детское учреждение или во время ОРВИ. В случае появления патологии в моче во время ОРВИ. При наследственном нефрите в отличие от приобретенного гломерулонефрита отсутствует латентный период.
В начальной стадии болезни самочувствие ребенка страдает мало, характерной особенностью является упорство и стойкость мочевого синдрома. Одним из основных признаков является гематурия различной степени выраженности, наблюдаемая в 100% случаев. Усиление степени гематурии отмечается во время или после инфекций дыхательных путей, физической нагрузки или после профилактических прививок. Протеинурия в большинстве случаев не превышает 1 г/сут, в начале заболевания может быть непостоянной, по мере прогрессирования процесса протеинурия нарастает. Периодически в мочевом осадке может присутствовать лейкоцитурия с преобладанием лимфоцитов, что связывают с развитием интерстициальных изменений.
В дальнейшем происходит нарушение парциальных функций почек, ухудшение общего состояния больного: появляются интоксикация, мышечная слабость, артериальная гипотония, часто нарушение слуха (особенно у мальчиков), иногда нарушение зрения. Интоксикация проявляется бледностью, утомляемостью, головными болями. В начальной стадии болезни снижение слуха в большинстве случаев выявляется только с помощью аудиографии. Снижение слуха при синдроме Альпорта может возникнуть в различные периоды детства, однако чаще всего тугоухость диагностируется в возрасте 6-10 лет. Начинается снижение слуха у детей с высоких частот, достигая значительной степени при воздушном и костном проведении, переходя из звукопроводящей в звуковоспринимающую тугоухость. Снижение слуха может быть одним из первых симптомов заболевания и может предшествовать мочевому синдрому.
В 20% случаев у больных с синдромом Альпорта отмечаются изменения со стороны органов зрения. Наиболее часто выявляются аномалии со стороны хрусталика: сферофокия, лентиконус передний, задний или смешанный, разнообразные катаракты. В семьях с синдромом Альпорта наблюдается значительная частота миопии. Ряд исследователей постоянно в этих семьях отмечают билатеральные перимакулярные изменения в виде ярких беловатых или желтоватых грануляций в области желтого тела. Они считают этот признак постоянным симптомом, который имеет высокую диагностическую ценность при синдроме Альпорта. К. S. Chugh и соавт. (1993) при офтальмологическом исследовании выявили у больных синдромом Альпорта снижение остроты зрения в 66,7% случаев, передний лентиконус - в 37,8%, пятна на сетчатке - в 22,2%, катаракту - в 20%, кератоконус - в 6,7%.
У части детей при наследственном нефрите, особенно при формировании почечной недостаточности, отмечают существенное отставание в физическом развитии. По мере прогрессирования почечной недостаточности развивается артериальная гипертензия. У детей она чаще выявляется в подростковом периоде и в более старших возрастных группах.
Характерно наличие у больных с наследственным нефритом разнообразных (более 5-7) стигм соединительнотканного дизэмбриогенеза. Среди соединительнотканных стигм у больных наиболее часто встречаются гипертелоризм глаз, высокое нёбо, аномалии прикуса, аномальная форма ушных раковин, искривление мизинца на руках, «сандалевидная щель» на стопах. Для наследственного нефрита характерна однотипность стигм дизэмбриогенеза внутри семьи, а также высокая частота их распространения у родственников пробандов, по линии которых передается болезнь.
На ранних этапах болезни выявляется изолированное снижение парциальных функций почек: транспорта аминокислот, электролитов, концентрационной функции, ацидогенеза, в дальнейшем изменения касаются функционального состояния как проксимального, так и дистального отдела нефрона и носят характер сочетанных парциальных нарушений. Снижение клубочковой фильтрации наступает позднее, чаще в подростковом периоде. По мере прогрессирования наследственного нефрита развивается анемизация.
Таким образом, для наследственного нефрита характерна стадийность течения болезни: сначала латентная стадия или скрытых клинических симптомов, проявляющаяся минимальными изменениями мочевого синдрома, затем наступает постепенная декомпенсация процесса со снижением почечных функций с манифестными клиническими симптомами (интоксикация, астенизация, отставание в развитии, анемизация). Клинические симптомы появляются обычно вне зависимости от наслоения воспалительной реакции.
Наследственный нефрит может манифестовать в разные возрастные периоды, что зависит от действия гена, который до определенного времени находится в репрессированном состоянии.
Классификация
Выделяют три варианта наследственного нефрита
- I вариант - клинически проявляется нефритом с гематурией, тугоухостью ипоражением глаз. Течение нефрита прогрессирующее с развитием ХПН. Тип наследования - доминантный, сцепленный с Х-хромосомой. Морфологически выявляется нарушение структуры базальной мембраны, ее истончение и расщепление.
- II вариант- клинически проявляется нефритом с гематурией без тугоухости. Течение нефрита прогрессирующее с развитием хронической почечной недостаточности. Тип наследования - доминантный, сцепленный с Х-хромосомой. Морфологически выявляется истончение базальной мембраны капилляров клубочков (особенно laminadensa).
- III вариант - доброкачественная семейная гематурия. Течение благоприятное, хроническая почечная недостаточность не развивается. Тип наследования - аутосомно-доминантный или аутосомно-рецессивный. При аутосомно-рецессивном типе наследования у женщин отмечено более тяжелое течение заболевания.
, , , ,
Диагностика синдрома Альпорта
Предложены следующие критерии:
- наличие в каждой семье не менее двух больных нефропатией;
- гематурия как ведущий симптом нефропатии у пробанда;
- наличие тугоухости хотя бы у одного из членов семьи;
- развитие хронической почечной недостаточности у одного родственника и более.
При диагностике разнообразных наследственных и врожденных заболеваний большое место принадлежит комплексному подходу к обследованию и прежде всего обращение внимания на данные, получаемые при составлении родословной ребенка. Диагноз синдрома Альпорта считается правомочным в случаях обнаружения у больного 3 из 4 типичных признаков: наличие в семье гематурии и хронической почечной недостаточности, присутствие у больного нейросенсорной тугоухости, патологии зрения, обнаружение при электронно-микроскопической характеристике биоптата признаков расщепления гломерулярной базальной мембраны с изменением ее толщины и неравномерностью контуров.
Обследование больного должно включать клинико-генетические методы исследования; направленное изучение анамнеза заболевания; общий осмотр больного с учетом диагностически значимых критериев. В стадии компенсации уловить патологию можно лишь ориентируясь на такие синдромы, как наличие наследственной отягощенности, гипотонии, множественных стигм дизэмбриогенеза, изменения мочевого синдрома. В стадии декомпенсации возможно появление эстраренальных симптомов, таких как выраженная интоксикация, астенизация, отставание в физическом развитии, анемизация, проявляющиеся и усиливающиеся с постепенным снижением почечных функций. У большинства больных при снижении почечных функций наблюдается: снижение функции ацидо- и аминогенеза; у 50% больных отмечают значительное снижение секреторной функции почек; ограничение пределов колебания оптической плотности мочи; нарушение ритма фильтрации, а затем и снижение клубочковой фильтрации. Стадия хронической почечной недостаточности диагностируется при наличии у больных в течение 3-6 мес и более повышенного уровня мочевины в сыворотке крови (более 0,35 г/л), снижение клубочковой фильтрации до 25% от нормы.
Дифференциальную диагностику наследственного нефрита приходится проводить прежде всего с гематурической формой приобретенного гломерулонефрита. Приобретенный гломерулонефрит имеет чаще острое начало, период 2-3 нед после перенесенной инфекции, экстраренальные признаки, в том числе гипертензию с первых дней (при наследственном нефрите, напротив, гипотония), снижение клубочковой фильтрации в начале заболевания, отсутствие нарушения парциальных канальцевых функций, тогда как при наследственном они присутствуют. Приобретенный гломерулонефрит протекает с более выраженной гематурией и протеинурией, с увеличенной СОЭ. Диагностическое значение имеют типичные изменения гломерулярной базальной мембраны, свойственные наследственному нефриту.
Дифференциальная диагностика от дисметаболической нефропатии проводится с хронической почечной недостаточностью, в семье клинически выявляются неоднотипные болезни почек, а может быть спектр нефропатии от пиелонефрита до мочекаменной болезни. У детей часто присутствуют жалобы на боли в животе и периодически при мочеиспускании, в осадке мочи - оксалаты.
В зарубежной и отечественной литературе имеются сообщения о лечении преднизолоном и использовании цитостатиков. Однако об эффекте судить трудно.
При хронической почечной недостаточности применяются гемодиализ и трансплантация почек.
Методов специфической (эффективной патогенетической) терапии наследственного нефрита не существует. Все лечебные мероприятия направлены на предупреждение и замедление снижения почечных функций.
Диета должна быть сбалансированной и высококалорийной, с учетом функционального состояния почек. При отсутствии нарушений функционального состояния в питании ребенка должно быть достаточное содержание белков, жиров и углеводов. При наличии признаков почечных дисфункции количество белка, углеводов кальция и фосфора следует ограничивать, что отдаляет сроки развития хронической почечной недостаточности.
Физические нагрузки должны быть ограничены, детям рекомендуется отказ от занятий спортом.
Следует избегать контактов с инфекционными больными, снижать риск развития острых респираторных заболеваний. Необходима санация очагов хронической инфекции. Профилактические прививки детям с наследственным нефритом не проводятся, вакцинация возможна только по эпидемиологическим показаниям.
Гормональная и иммуносупрессивная терапия при наследственном нефрите неэффективна. Есть указания на некоторый положительный эффект (снижение уровня протеинурии и замедление прогрессирования заболевания) при длительном многолетнем применении циклоспорина А и ингибиторов АПФ.
В терапии больных используют препараты, улучшающие обмен:
- пиридоксин - по 2-3 мг/кг/сут в 3 приема в течение 4 недель;
- кокарбоксилаза - по 50 мг внутримышечно через день, всего 10-15 инъекций;
- АТФ - по 1 мл внутримышечно через день, 10-15 инъекций;
- витамин А - по 1000 ЕД/год/сут в 1 прием в течение 2 недель;
- витамин Е - по 1 мг/кг/сут в 1 прием в течение 2 недель.
Подобная терапия способствует улучшению общего состояния больных, снижению тубулярных дисфункций и проводится курсами 3 раза в год.
В качестве иммуномодулятора может быть использован левамизол - по 2 мг/кг/сут 2-3 раза в неделю с перерывами между приемами в 3-4 дня.
Поданным исследований положительный эффект на выраженность гематурии и нарушений функции почек оказывает гипербарическая оксигенация.
Наиболее эффективным методом лечения наследственного нефрита является своевременная трансплантация почки. При этом не отмечается рецидива заболевания в трансплантате, в небольшом проценте случав (около 5%) возможно развитие нефрита в трансплантированной почке, связанного с антигенами к гломерулярной базальной мембране.
Перспективным направлением является пренатальная диагностика и генно-инженерная терапия. Эксперименты на животных показывают высокую эффективность переноса нормальных генов, ответственных за синтез а-цепей коллагена IV типа, в почечную ткань, после чего отмечается синтез нормальных коллагеновых структур.
Синдром Альпорта представляет собой генетическое заболевание почек, сопровождающееся снижением остроты слуха и зрения. По статистике диагностируют порядка 17 случаев на 100 тыс. человек. Чаще всего встречается у мужчин, но болеют также и женщины. Обычно первые симптомы появляются в возрасте 3–8 лет, но может протекать и без характерных признаков.
В официальной медицине выделяют несколько форм и стадий Синдрома Альпорта. Каждая из них отличается рядом характерных симптомов, а также тяжестью протекания заболевания. К основным формам синдрома относятся:
- Наследственный нефрит у детей характеризуется наличием только почечной симптоматики. При этом снижение слуха и зрения у пациентов не наблюдается.
- При исследовании тканей почек происходит изолированное истончение базальных мембран.
- Заболевание сопровождается не только патологиями почек, но и проявляется в виде ухудшения слуха и зрения.
Классификация синдрома Альпорта делится по тяжести и скорости прогрессирования симптомов. Выделяют 3 типа:
- Болезнь прогрессирует крайне быстро, и переходит в почечную недостаточность. При этом симптоматика ярко выражена.
- Заболевание прогрессирует довольно быстро, но не влияет на слух и зрение.
- Течение болезни относится к доброкачественным. Характерных симптомов, а также прогрессирования не наблюдается.
Причины развития
Единственной причиной возникновения у человека синдрома Альпорта является генетическая мутация. Повреждаются 3 гена, которые находятся во 2-й хромосоме. Именно в них хранится информация о цепочках коллагенов, которые влияют на работу почек.
Поврежденный ген чаще всего наследуется ребенком от его родителей по Х-хромосоме. В связи с этим патология может передаться детям любого пола от матери, а от отца – только девочке. Вероятность рождения с поражением почек выше, если в роду есть люди с наследственными болезнями мочевыделительной системы.
На каждый пятый случай рождения ребенка с синдромом Альпорта, приходится случайная мутация генов. При этом у родителей и близких родственников нет генетических нарушений и идеально здоровые почки.
Симптоматика
Клинические симптомы синдрома Альпорта ярко выражена. Начальная стадия сопровождается снижением слуха и наличием крови в моче.
Однако если заболевание прогрессирует, тогда симптомы более выражены. Происходит интоксикация организма, и развивается анемия. Связанно это с резким снижением уровня гемоглобина. В результате чего появляются дополнительные симптомы:
- перепады артериального давления;
- частая головная боль;
- учащенное поверхностное дыхание;
- шум в ушах;
- быстрая утомляемость.
Еще одним характерным признаком является нарушение биологического ритма. Сонливость днем и бессонница ночью чаще всего возникает у маленьких детей и пожилых людей. Общая симптоматика зависит от возраста, а также состояния здоровья больного.
Хроническая форма синдрома Альпорта сопровождается такими симптомами, как:
- частое мочеиспускание, не приносящее облегчение;
- недомогание;
- наличие крови в моче;
- судороги;
- общая слабость;
- тошнота, сопровождающая рвотой;
- отсутствие аппетита;
- боль в груди;
- кровоподтеки и зуд кожи.
В редких случаях пациент при хроническом синдроме Альпорта впадает в беспамятство или страдает из-за спутанного сознания. Однако у детей такие симптомы практически не возникают.
Методы лечения
 Синдром Альпорта на данный момент считается неизлечимым заболеванием. Но существуют исследования по результатам которых (при прогрессировании почечной недостаточности), эффективно применять ингибиторы АПФ - препараты, применяющиеся для лечения и профилактики сердечных заболеваний. По вторым исследованиям эффективно использовать антагонисты АТII-рецепторов. Те и другие виды препаратов снижают внутриклубочковое давление, что позволяет значительно снизить протеинурию. Кроме того, ингибирование ангиотензина-II способно уменьшить склерозирование сосудов.
Синдром Альпорта на данный момент считается неизлечимым заболеванием. Но существуют исследования по результатам которых (при прогрессировании почечной недостаточности), эффективно применять ингибиторы АПФ - препараты, применяющиеся для лечения и профилактики сердечных заболеваний. По вторым исследованиям эффективно использовать антагонисты АТII-рецепторов. Те и другие виды препаратов снижают внутриклубочковое давление, что позволяет значительно снизить протеинурию. Кроме того, ингибирование ангиотензина-II способно уменьшить склерозирование сосудов.
В самом начале находится исследование, задача которого доказать влияние циклоспорина на нормализацию почечной функции. Но этот препарат в некоторых случаях приводит к ускорению интерстициального фиброза.
Современные лаборатории занимаются изучением лечения болезни при помощи генной терапии, но говорить о каких-либо результатах преждевременно.
Ударное, комплексное лечение применимо только в случае, если существует явная угроза жизни. На начальной стадии болезнь не лечат.
Если появились почечные симптомы у ребенка, необходимо придерживаться особого режима и выполнять рекомендации врача, которые заключаются в следующих мерах:
- Ребенок должен быть освобожден от серьезных физических нагрузок - не рекомендуется посещать уроки физкультуры и ходить на спортивные секции.
- Рекомендуются частые прогулки на свежем воздухе.
- При появлении крови в моче или других симптомов, можно применять фитотерапию. Эффективно пить сок черноплодной рябины, а также отвар или настой тысячелистника и крапивы.
- Следует правильно питаться. В рационе должны отсутствовать копченые, соленые, жирные, пряные и острые блюда. Лучше избегать продуктов, в состав которых входят искусственные красители. Алкоголь при таком заболевании полностью запрещается, но при развитии анемии больному можно пить небольшое количество красного сухого вина.
- Для улучшения обмена веществ необходимо пить комплекс витаминов: E, A и B6. Лучше принимать курсами по две недели.
- Чтобы повысить обмен веществ также рекомендуется делать инъекции Кокарбоксилазы.