1455 0
Термин «миелодисплазия» применяется для описания морфологических аномалий, или дисплазии одной или более миелоидных линий гемопоэза, что является типичной чертой миелодиспластического синдрома (МДС) .
Согласно классификации ВОЗ (2008) опухолей гемопоэтических и лимфоидных тканей, МДС определяется как клональное заболевание гемопоэтических стволовых клеток, характеризующийся цитопенией, миелодисплазией, неэффективным гемопоэзом и повышенным риском прогрессии в острый миелоидный лейкоз (ОМЛ) .
Клинические различия между МДС и вторичным ОМЛ базируются исключительно на цитоморфологическом исследовании, поскольку пациенты с МДС имеют диспластический гемопоэз и количество миелобластов менее 20%, в то время как пациенты с количеством миелобластов более 20% относятся к ОМЛ.
Однако данные по исследованию простого нуклеотидного полиморфизма и секвентирования отдельных генов привели к выводу, что клональная популяция клеток при миелодиспластических синдромах может быть выше 20%. Геном при МДС и вторичном остром миелоидном лейкозе состоит из основного клона клеток, определяемого как мутантный кластер, имеющий более высокую массу мутантного аллеля.
При исследовании клеток костного мозга при МДС большинство клеток были клональны и неотличимы от клеток костного мозга при вторичном ОМЛ, даже при количестве миелобластов менее 5%. Это позволяет считать, что количество миелобластов не определяет объем клональной популяции при МДС и клональный гемопоэз занимает значительный плацдарм в костном мозге на ранних стадиях МДС.
Современные методы диагностики МДС включают исследование морфологии клеток периферической крови для исключения аномалий клеток крови и гемопоэтических клеток-предшественниц, биопсию костного мозга с определением клеточности, наличия фиброза, проведения цитогенетического и молекулярно-генетического исследования для идентификации хромосомных аномалий.
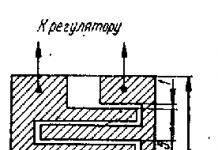
Морфологические аномалии при миелодисплазии представлены на рис. 24.
Рис. 24. Примеры морфологических аномалий при миелодисплазии
Миелодисплазии могут быть найдены и при других миелоидных новообразованиях, указанных в классификации ВОЗ (2008) и приведенных в табл. 28. (Классификация опухолей гемопоэтических и лимфоидных тканей, Swerdlow S.H. et al., (2008).
Таблица 28. Классификация миелоидных новообразований (ВОЗ, 2008)

Хотя разные субтипы миелоидных новообразований имеют разные характеристики, при них могут быть сходные морфологические аномалии. Пример тому - рефрактерная анемия с кольцевыми сидеробластами (РАКС) , ассоциированная с выраженным тромбоцитозом (РАКС-Т), которая имеет как миелодиспластический характер, так и миелопролиферативные характеристики эссенциальной тромбоцитемии. Возможно, что миелодиспластические данные различных миелоидных новообразований могут отражать общие генетические повреждения, лежащие в их основе.
Заболеваемость миелодиспластическими синдромами составляет 4-5 случаев на 100 000 населения в год. Он является наиболее частым миелоидным новообразованием в возрасте старше 80 лет. Относительными факторами риска являются курение, контакт с органическими растворителями, ионизирующее излучение, мужской пол, а также предшествующая терапия алкилирующими агентами и ингибиторами топоизомеразы II.
Патогенез МДС характеризуется повышенной пролиферативной активностью кроветворных клеток и их повышенным апоптозом. Установлено, что рецепторы смерти (Fas, ФНО-а и TRAIL) и Fas-ассоциированный домен смерти (FADD) могут быть гиперэкспрессированы при МДС. Внутренний путь апоптоза играет большую роль в апоптозе клеток при МДС.
Проапоптотические члены семейства Bcl-2 проявляют обратную регуляцию в группе низкого риска, что ведет к усиленной передаче сигналов апоптоза. Имеющиеся нарущения в митохондриях вследствие отложения в них железа приводят к выходу из них цитохрома с, что активирует каспазы и усиливает апоптоз.
Мутации митохондриальной ДНК выявлены более чем у половины пациентов с МДС. Кроме того, аутологичные CD8+ Т-лимфоциты могут супрессировать рост эритроидных и гранулоцитарных прогениторов при МДС. Появление признаков дисплазии кроветворных клеток служит морфологическим отражением неэффективности гемопоэза при миелодиспластических синдромах, а характер этой дисплазии (одно-, двух- и трехлинейная) определяет вариант МДС.
В 2008 г. ВОЗ разработала классификацию МДС, которая приводится ниже в табл. 29.
Таблица 29. Классификация миелодиспластического синдрома (ВОЗ, 2008)

Цитопенией является снижение уровня гемоглобина ниже 100 г/л, уровня тромбоцитов ниже 100,0х10 9 /л, абсолютного количества гранулоцитов ниже 1,8х10 9 /л. Пациенты с подозрением на МДС, но при неполном соответствии современным критериям, продолжительностью цитопении более 6 мес. и при отутствии других ее причин могут быть отнесены в категорию идиопатической цитопении неуточненного происхожения.
Такие пациенты требуют наблюдения с выполнением повторных стернальных пункций. Для диагностики, классификации и прогнозирования МДС необходимо исследование морфологии клеток периферической крови (эритроцитов, тромбоцитов и лейкоцитов) и костного мозга (степень созревания гранулоцитов, мегакариоцитов и эритроидных клеток-предшественниц) с целью идентификации дисплазии.
Диспластические изменения должны присутствовать не менее чем в 10% клеток соответствующей линии (миелоидной, эритроидной или мегакариоцитарной). Окраска на железо должна проводиться во всех аспиратах костного мозга с целью выявления сидеробластов, которые должны составлять около 15% от всех эритробластов при РАКС или РЦМД-КС.
Исследование трепаната необходимо для уточнения клеточности и степени фиброзирования, наличия ретикулина, идентификации гипоклеточного костного мозга и перекреста миедиспластического/миелопролиферативного синдромов. При гипоклеточном костном мозге диагноз МДС подтверждает дисплазия миелодной и/или мегакариоцитарной линий, поскольку эритроидная дисплазия часто бывает при апластической анемии.
Проточная цитометрия не является обязательной для диагностики миелодиспластических синдромов в связи с отсутствием специфических иммунофенотипических данных. Выявление множественных цитометрических аберрантных аномалий может подтверждать диагноз МДС с интерпретацией связи с морфологическими и цитогенетическими данными.
Наиболее частыми находками являются аберрантная экспрессия антигенов миелобластных, созревающих миелоидных, моноцитоидных и эритроидных линий, снижение количества прогениторов В-лимфоцитов, повышение количества CD34+ клеток, хотя во многих случаях экспрессия антигенов недостоверна.
Международная прогностическая шкала при миелодиспластических синдромах
С целью прогнозирования течения МДС на основании анализа кариотипа, количества бластов в костном мозге и тяжести цитопении была разработана Международная прогностическая шкала (International Prognostic Scoring System - IPSS).На основании ее были сформированы три группы пациентов с МДС, различающиеся по выживаемости и по риску трансформации в ОМЛ. На основании кариотипа в рамках IPSS были выделены группа благоприятного, промежуточного и неблагоприятного прогноза.
В дальнейшем в связи с расширением выявляемых хромосомных аберраций была разработана новая прогностическая шкала кариотипа - R-IPSS, содержащая пять самостоятельных вариантов кариотипа, согласующаяся с медианой выживаемости больных МДС.
Данная классификация приведена ниже (табл. 30).
Таблица 30. Международная прогностическая шкала МДС - R-IPSS

По данным С.В. Грицаева и др., с учетом критериев R-IPSS, среди пациентов с миелодиспластическими синдромами группа с очень хорошим прогнозом составила 3%, с хорошим - 48,2%, с промежуточным - 25,9%, высокого риска - 3,6%, очень высокого риска - 19,3%.
В то же время по критериям IPSS группа благоприятного прогноза составила 46,2%, промежуточного - 26,4%, неблагоприятного -27,4%. При объединении вариантов R-IPSS очень хорошей и хорошей подгрупп (51,3%), а также групп высокого и очень высокого риска (22,9%), достоверных различий по распределению пациентов по прогностическим вариантам кариотипа двух шкал не выявлено. Однако преимущества R-IPSS классификации состоят в следующем.
В ней представлены 10 дополнительных аберраций и сформированы пять самостоятельных вариантов кариотипа. Использование ее критериев дает возможность стратификации 84% пациентов с МДС. Критерии прогностической шкалы, согласно критериям R-IPSS, приведены в табл. 31.
Таблица 31. Критерии прогностической шкалы R-IPSS при МДС

В зависимости от количества баллов прогностической шкалы по критериям R-IPSS выделены категории риска с учетом выживаемости и эволюции в ОМЛ.
Однако R-IPSS не является динамической системой и может только прогнозировать исход при установлении диагноза у каждого пациента.
Изменения кариотипа при МДС
Основным компонентом МДС, согласно определению ВОЗ, является клональная природа миелодиспластического миелопоэза. Хотя для подтверждения существования клональной популяции гемопоэтических стволовых клеток могут применяться различные методики, наиболее весомой из них является определение хромосомных аномалий или дискретной реаранжировки генов с присутствием этих маркеров в выделенной популяции гемопоэтических клеток.Благодаря этим методикам были найдены хромосомные аберрации в коммитированных миелоидных клетках-предшественницах почти у 50% пациентов с МДС; при этом гемопоэтические клетки с генетическими поражениями способны дифференцироваться до стадии зрелых миелоидных клеток.
При стойкой цитопении неуточненного происхождения и при отсутствии абсолютных морфологических критериев МДС как предполагаемое свидетельство наличия МДС рассматривают следующие хромосомные аномалии:
Несбалансированные аномалии: -7 или del(7q); -5 или del(5q); i(17q) или t(17p); -13 или del(13q); del(11q); del(12p) или t(12p); del(9q); idic(X)(13q);
- сбалансированные аномалии: t(11;16)(q23;p13.3); t(3;21)(q26.2;q22.1); t(1;3)(p36.3;q21.1); t(2;11)(p21;q23); inv(3)(q21;q26.2); t(6;9)(p23;q34);
- комплексный кариотип (наличие 3 или более хромосомных аномалий) плюс вышеупомянутые нарушения.
Наличие +8 и - Y, del(20q) изолированно без морфологических критериев не является доказательством наличия МДС. Также наличие других аномалий в случаях стойких цитопений без четких морфологических признаков дисплазии указывает на возможный диагноз МДС. При вторичном МДС наиболее часто встречаются несбалансированные аномалии: -7q/del(7q) и -5/del(5q) - в 50% и 40% соответственно (М.А. Пименова и др. 2013).
Некоторые цитогенетические аномалии, выявленные при МДС, определяются и при остром миелоидном лейкозе , что позволяет говорить об общем происхожении части этих двух заболеваний. Сбалансированные цитогенетические аномалии, в том числе реципрокные транслокации значительно реже наблюдаются при МДС (чаще встречаются несбалансированные хромосомные аномалии, отражающие присоединение или потерю хромосомного материала), чем при ОМЛ.
Определение основных и субклональных ведущих мутаций позволяет улучшить прогностику МДС и изменить клинические подходы к терапии. Во-первых, идентификация мутантных генов, ответственных за образование изначального клона, определяет клинический исход. Во-вторых, выявление субклональных ведущих мутаций, ассоциированных с малым мутантным клоном, определяет раннее выявление прогрессирования заболевания, включая эволюцию в ОМЛ.
В-третьих, количество ведущих мутаций у каждого пациента представляет значимый прогностический фактор в отношении средней безрецидивной выживаемости. К тому же характеристика генома пациента определяет программу терапии. Мутации ТЕТ2 ассоциированы с хорошим ответом на гипометилирующие препараты, в то время как мутации U2AF1 являются независимым предиктором плохого исхода при выполнении аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК) .
Таргетная терапия
Терапевтический потенциал эпигенетической таргетной терапии при ОМЛ может быть применим при МДС. Идентификация биологических путей, которые активируются при мутациях, могут служить для персонализации терапии у пациентов с МДС. Характеристика генома пациента до и после терапии является критерием эффекта.При секвентировании генома (M.J.Walter et al., 2012), было показано, что идентичные соматические мутации выявлены в клетках костного мозга при ОМЛ, развившегося из МДС, и в клетках костного мозга у тех же пациентов при предшествующем заборе в фазе МДС. Была выявлена клональность в 85-90% нефракционированных клеток костного мозга этих пациентов как в фазе МДС, так и в фазе острого миелоидног лейкоза, независимо от количества бластов.
Секвентирование генома выявило, что количество опухолевых клеток костного мозга не различалось при МДС и вторичном ОМЛ; поэтому можно считать, что МДС такой же клональный, как и вторичный ОМЛ, даже при нулевом уровне миелобластов. Изначальный мутантный клон предсуществующего МДС присутствует и при вторичном ОМЛ, хотя в некоторых случаях он дополняется дочерними субклонами.
Вследствие приобретения новых мутаций в процессе эволюции субклоны содержат повышенное количество мутаций. Эти данные показывают, что клетки миелоидной линии (незрелые клетки-предшественницы эритроцитов, гранулоцитов, моноцитов, мегакариоцитов) являются клональными у пациентов с МДС на любой стадии, не только после трансформации в ОМЛ.
Согласно современной модели концепции патофизиологии миелодисплазии (M. Cazzola et al, 2013), появление основных ведущих мутаций в незрелых гемопоэтических клетках ведет к повышенному их самовосстановлению. Мутации, типично вовлекающие гены сплайсинга РНК или метилирования ДНК, дают клеткам селективное преимущество и определяют локальную клональную экспансию.
Имея клональное преимущество, мутированные гемопоэтические стволовые клетки активно мигрируют и прогрессивно заселяют другие зоны костного мозга, приобретая полное клональное доминирование в организме. Клональные клетки в дальнейшем приобретают множество основных и сопутствующих мутаций, усиливающих клональную пролиферацию.
В конечном итоге клетки костного мозга, происходящие из клона, имеют изначальные ведущие мутации плюс дополнительные мутации. Сопутствующие мутации могут иметь или не иметь отношение к развитию клиники заболевания, но являются причиной аномальных дифференцировки/созревания клональных гемопоэтических прогениторов и прекурсоров.
Нарушение пролиферации и/или дефектного созревания и/или избыточного апоптоза более часто ведут к дисплазии, неэффективному гемопоэзу и цитопении в периферической крови; однако при мутации некоторых ведущих генов может наблюдаться лейкоцитоз или тромбоцитоз.
Приобретение клональными клетками субклональных ведущих мутаций типично вовлекает гены модификации хроматина, регуляции транскрипции или сигнальной трансдукции, вызывая образование субклонов гемопоэтических стволовых клеток с дальнейшим нарушением способности к дифференцированию и созреванию.
В результате количество бластов прогрессивно нарастает, что ведет к развитию ОМЛ. При этом нет моноклональности в строгом смысле слова, но наличие мозаицизма клона/генома характеризует различные наборы соматических мутаций (концепция внутриклональной или внутриопухолевой гетерогенности). Авторы исследовали достоверность сочетания пар мутантных генов с менее чем четырьмя мутациями с прогностической группой у пациентов с МДС. Данные в табл. 32.
Таблица 32. Сочетание пар мутантных генов и прогностические группы при МДС

В приводимой ниже схеме (рис. 25) представлено сочетание отдельных мутантных генов и групп генов при МДС. Представлены ведущие гены, группы генов и значимость их мутаций при определении цитогенетических групп риска (благоприятная, промежуточная, неблагоприятная).

Рис. 25. Взаимосвязь мутантных генов и прогностических групп при МДС
Клональная архитектура
Клональная архитектура МДС была изучена при идентификации мутации гена TET2. Клетки CD34+ пациентов с МДС были фракционированы на незрелые CD34+CD38- и зрелые CD34+CD38- предшественницы. Мутации гена TET2 были найдены только в малой фракции CD34+CD38- клеток, однако в более зрелых клетках-предшественицах они присутствовали в большом количестве.Согласно этому, начальные соматические мутации гена TET2 наблюдались в CD34+CD38- клетках и в дальнейшем переходили в CD34+CD38+ клетки-предшественницы.
При обусловленном предшествующей терапией МДС наиболее часто встречаются мутации гена ТР53 (24-46%), часто в ассоциации с аномалиями хромосомы 5. Мутации гена AML1 наблюдаются в 13-38% данного типа МДС, чаще в сочетании с del(7q) или -7.
Интерстициальная делеция длинного плеча хромосомы 5 del(5q) является наиболее частой аномалией, или изолированной (в половине случаев) или в сочетании и с другими генетическими аномалиями и наблюдается примерно у 30% пациентов.
В порядке нисходящей частоты наблюдаются -7/del(7q) в 21% аномального кариотипа, +8(16%), -18/18q(7%), 20q-(7%), -5(6%), -Y(5%), -17/17p- iso(17q)(5%), +Mar(5%), +21(4%). Делеции хромосом 18/18q, 5, 13/13q и 21 очень редко бывают изолированными. Исследования некодирующих генов области 5q31-5q35 показали снижение экспрессии миРНК-145 и миРНК-146а в клетках костного мога у пациентов с del(5q). Деплеция этих двух миРНК приводит к различной степени нейтропении, тромбоцитозу, гипосегментации ядер мегакариоцитов и снижению митотической активности в костном мозге.
Наличие мутаций генов
Наличие мутаций генов и частота их нахождения при МДС в разных прогностических группах отражено в табл. 33.Таблица 33. Частота мутаций генов в разных прогностических группах при МДС

Наличие в незрелых гемопоэтических стволовых клетках соматических мутаций, обеспечивающих повышение выживания, преимущества в росте и снижение апоптоза ведет к формированию локального мутантного клона. Чтобы этот клон начал доминировать в организме, мутированные стволовые клетки должны получить дополнительные преимущества. Остается неясным механизм, согласно которому неопластические гемопоэтические стволовые клетки оставляют место первичной мутации и мигрируют в другие костномозговые зоны.
В конечном итоге, мутированные гемопоэтические стволовые клетки полностью доминируют в костном мозге, и большинство циркулирующих зрелых клеток происходят из этого доминантного клона. Клинические проявления зависят от того, какой клон доминирует в костном мозге; мутации гена ТЕТ2 определяют длительное существование клонального гемопоэза без клинических проявлений, согласуясь с тем, что для фенотипической экспрессии может потребоваться кооперирование мутантных генов.
Гемопоэз при МДС характеризуется избыточным апоптозом гемопоэтических клеток-предшественниц, что ведет к развитию заболевания с малым риском прогрессирования в остром миелоидном лейкозе. Неэффективный гемопоэз, а именно гибель в костном мозге эритробластов, незрелых гранулоцитов, моноцитов и мегакариоцитов, несет ответственность за дефектную продукцию зрелых клеток крови и цитопению в периферической крови. Соматические мутации вызывают увеличение количества стволовых клеток с потерей их функции на уровне гемопоэтических клеток-предшественниц.
При естественном течении МДС пациенты имеют высокий риск прогрессии в ОМЛ. Наиболее вероятной причиной этого является приобретение дополнительных соматических мутаций, ведущих к образованию субклонов гемопоэтических клеток с дальнейшим нарушением способности к дифференцировке и/или созреванию.
Количество бластов постепенно увеличивается и в итоге развивается ОМЛ. Данные исследований показывают, что эволюция опухоли последовательно проходит от кластера с одной мутацией клеток до кластера с 1-5 мутациями, при этом каждый новый клон накапливает патогенные и непатогенные мутации.
В целом количество специфических мутаций при вторичном ОМЛ с быстрым прогрессированием всегда меньше, чем при вторичном остром миелоидном лейкозе с медленным прогрессированием. Вторичный ОМЛ, развившийся из МДС, не является моноклональным, но состоит из мозаики нескольких клонов/геномов с различным количеством соматических мутаций, подтверждая концепцию внутриклональной или внутриопухолевой гетерогенности.
U. Germing et al. проведен мультивариантный анализ различных прогностических параметров для определения выживаемости и эволюции в ОМЛ. Неблагоприятными прогностическими параметрами, влияющими на ОВ, были следующие: комплексный кариотип, бласты в костном мозге >5%, уровень ЛДГ >750 Ед/мл, возраст >70 лет, гемоглобин
Этими же авторами выделены неблагоприятные прогностические факторы для эволюции в ОМЛ: бласты в костном мозге >5%, комплексный кариотип, мужской пол, уровень лактатдегидрогеназы (ЛДГ)
> 750 ЕД/мл, гемоглобин
Для диагностики и выделения прогностических групп при МДС играет весьма значимую роль определение наличия повторяющихся хромосомных аномалий, которые выявляются примерно у 50% пациентов с МДС. Наиболее часто это единичные цитогенетические аномалии: del(5q), трисомия 8, del(20q), моносомия 7 или del(7q).
Обычно эти генетические изменения вторичные, за исключением del(5q), для которой характерен синдром 5q-. Выявление цитогенетических аберраций у пациентов с цитопенией в периферической крови и дисплазией в костном мозге является важным признаком клональной пролиферации. И наоборот, диагноз МДС может быть затруднителен у пациентов с нормальным кариотипом или неинформативными цитогенетическими данными.
Значение мутаций сплайсингосом в клональной пролиферации. Сплайсинг пре-мРНК катализируется сплайсингосомами, которые являются макромолекулами, состоящими из 5 малых нуклеарных РНК, связанных с протеинами в форме частичек - малых нуклеарных рибонуклеотидов.
При объективном секвенировании генома и экзома образцов, полученных от пациентов с МДС, выявлены мутации в генах, кодирующих основные компоненты сплайсингосом РНК, включая гены SF3B1, SRSF2, U2AF1 и ZRSR2. Мутации в этом направлении очень распространены при миелоидных злокачественных заболеваниях и, как правило, чаще встречаются при заболеваниях, характеризуемых морфологической дисплазией, таких как МДС, хронический миеломоноцитарный лейкоз (ХММЛ), лейкоз, ассоциированный с лечением и ОМЛ с изменениями, связанными с миелодисплазией.
С другой стороны, сплайсинговые мутации реже встречаются при миелоидных заболеваниях без дисплазии, включая первичный острый миелоидный лейкоз и миелопролиферативные новообразования. Более чем 50% пациентов с МДС имеют соматические мутации в генах сплайсингосом, кодирующих протеины; мутации редко выявляются в детском возрасте, согласуясь с тем, что они являются типично приобретенными, поскольку чаще выявляются у пожилых пациентов.
Эти мутации ведут к накоплению неспецифических клеточных аномалий в большей степени, чем к развитию клональной пролиферации. Различные мутации сплайсингосом ассоциированы с разными фенотипами и разным клиническим исходом. Соматические мутации SF3B1 исключительно выявляются у пациентов с РАКС без или с тромбоцитозом и сочетаются с хорошим клиническим исходом и малой наклонностью к трансформации в ОМЛ.
Мутации SRSF2 находят в основном у пациентов с мультилинейной дисплазией и/или с избытком бластов и сочетаются с выоким риском исхода в ОМЛ и с низкой выживаемостью. Эти мутации определяются в 20% случаев вторичного острого миелоидного лейкоза как следствие трансформации МПН и часто ассоциируются с мутациями ТЕТ2.
Наличие часто повторяющихся соматических мутаций во многих сплайсингосомальных генах предполагает, что нарушение сплайсинга РНК может обусловливать клональное доминирование миелоидных злокачественных заболеваний. Мутации сплайсингосом главным образом ограничены белками, участвующими в распознавании сплайсинга и функционировании U2 малой ядерной рибонуклеопротеидной единицы.
Это указывает на то, что прерывание распознавания сплайсинга может нарушать сплайсинг последовательно посредством влияния на использование экзона или активирование альтернативных сайтов сплайсинга. Неправильное функционирование сплайсингосом может способствовать появлению новых изоформ белка с изменённой функцией, индуцирующих эктопическую экспрессию изоформ белка, несвойственных для данной ткани или вызывает количественные изменения генной экспрессии посредством разрушения с участием нонсенс-мутаций.
В начальных исследованиях не было выявлено чётких примеров нарушений сплайсинга, ассоциированных с мутациями, что повышает вероятность того, что эти мутации могут нарушать неутверждённые функции сплайсингосом. В дополнение к опосредованному созреванию предшественника мРНК было показано, что сплайсинговые белки влияют на преобразования гистона посредством взаимодействия с белками группы Polycomb, активируют транскрипцию посредством прямого или непрямого влияния на элонгацию РНК-полимеразы, и координируют аспекты клеточного ответа на повреждение ДНК.
Соответствующая исключительность сплайсинговых мутаций указывает на то, что эти повреждения являются либо функционально излишними или, что более важно, прерывание облигатной или факультативной сплайсинговой активности не переносится клеткой.
Соматические мутации генов, кодирующих эпигенетическую регуляцию. Нарушение дифференцировки при МДС часто ассоциировано с соматическими мутациями в генах, которые контролируют метилирование ДНК (TET2, DNMT3A, IDH1/IDH2) или регулируют модификацию хроматина (ASXL1 и EZH2).
В 2009 г. была выявлена мутация гена ТЕТ2 в очень ранних предшественницах или гемопоэтических стволовых клетках, поскольку мутации были найдены в CD34+ и CD3+ Т-клетках. ТЕТ2 является ферментом, который превращает 5-метилцитозин в 5-гидроксиметилцитозин, и эта мутация ассоциирована с изменением каталитической активности в миелоидных новообразованиях.
Мутации ТЕТ2 определяются у 20-50% пациентов с МДС, чаще у пожилых женщин, обычно при наличии гематологической клональности без проявления гематологического фенотипа. Исследования выявили факт, что мутации ТЕТ2 ведут к повышению самовосстановления гемопоэтических стволовых клеток и к клональной миелоидной пролиферации, а также могут обусловливать ответ при применении гипометилирующих препаратов.
Эти мутации часто выявляются у пациентов с нормальным кариотипом, и поэтому являются четким маркером клональности. Имеет значение их ассоциация с укорочением выживаемости у пациентов промежуточной прогностической группы при ОМЛ.
Соматические мутации DNMT3A определяются у 10-15% пациентов с разными типами МДС, обычно ассоциированы с неблагоприятным клиническим исходом и более быстрым прогрессированием в ОМЛ у пациентов с РЦМД и РАИБ, но не у пациентов с РАКС, возможно потому, что сочетание с мутациями SF3B1 нивелирует негативное влияние мутации DNMT3A. В целом гиперметилирование любых генов тумор-супрессоров ассоциировано со снижением общей выживаемости и повышенным риском лейкозной трансформации. Мутации DNMT3А с потерей ее функции приводят к снижению метилирования ДНК и к гипометилированию в целом.
При МДС были выявлены мутации IDH1 и IDH2, причем наиболее часто были мутации IDH1-R132. Показано, что мутации IDH1 наблюдаются в группе МДС плохого прогноза и могут играть патогенетическую роль в эволюции заболевания. Мутации IDH1 и IDH2 часто сочетаются с мутациями ТЕТ2; представляет интерес тот факт, что 2-гидроксиглютарат, продуцируемый мутантным протеином IDH, интерферирует с превращением ТЕТ2 5-метилцитозина в 5-гидроксиметилцитозин.
Таким образом, мутации IDH1/IDH2 перекрещиваются с гиперметилированием в клетках с мутантным геном ТЕТ2 и экспрессия мутантных IDH1/IDH2 или деплеция ТЕТ2 нарушает гемопоэтическую дифференцировку и повышает экспрессию маркеров стволовых и прогениторных клеток, что является частым механизмом лейкозогенеза. Повторяющиеся мутации генов IDH1/IDH2 найдены у пациентов с ОМЛ и МДС. Если при ОМЛ сочетание мутации NPM1 и мутации IDH1 или IDH2 ассоциированы с хорошим клиническим исходом, то при МДС мутации IDH1 ассоциированы с короткой безрецидивной выживаемостью.
Механизм ремоделирования хроматина является комплексным и динамичным, включая взаимодействие между факторами транскрипции, некодирующими РНК, ДНК и гистон модифицирующими ферментами.
Ремоделирование хроматина производится двумя путями:
1. Посттрансляционная модификация частей гистоновых протеинов с изменением физической структуры хроматина. Эта модификация может уплотнять ДНК вокруг гистонов, при этом хроматин переходит в закрытую форму и транскрипция репрессируется (деацетилирование Н3К27, Н3К9, Н3/Н4), или открывает хроматин для транскриционной активности (ацетилирование Н3К4, Н3К3б, Н3/Н4).
2. Метилирование ДНК с превращением цитозина в 5-метилцитозин обычно в островках CpG посредством ДНКметилтрансфераз (DNMT). Метилированные островки CpG действуют как промоторы, снижая транскрипционную активность.
При миелодиспластических синдромах и вторичном ОМЛ аберрантное метилирование ДНК вовлекает специфические регионы хромосом и множество генов. Частота специфических мутаций вариирует в различных исследованиях и зависит от подгруппы МДС.
При МДС мутируют два гена, вовлеченные в модификацию хроматина и регуляцию: ASXL1, который взаимодействует с репрессирующим комплексом 1 и 2 поликомб-группы (PRC1 и PRC2) и EZH2, взаимодействующий с PRC2. Мутации ASXL1 вызывают усиление миелоидной трансформации вследствие потери обусловленной PRC2 репрессии гена и найдены в различных миелоидных новообразованиях, включая МДС. ASXL1 может действовать как комплекс репрессии или активации, и ассоциирован с комплексом деубиквитиназы гистона Н2А.
Мутации ASXL1 часты не только при миелодиспластических синдромах, но также при ХММЛ и первичном миелофиброзе и в целом ассоциированы с плохим клиническим исходом во всех миелоидных новообразованиях; их наличие является отрицательным прогностическим фактором.
В отличие от благоприятного прогноза, ассоциированного с изолированной del(5q), пациенты с del(7q) или моносомией 7 имеют неблагоприятный прогноз, хотя у них хороший эффект оказывают деметилирующие препараты. Чаще всего мутации (делеции) выявляются в области гена EZH2 при миелодиспластических синдромах, МДС/МПН или МПН и являются независимым прогностическим признаком.
В целом EZH2 функционирует как метилтрансфераза гистона Н3К27 и ассоциируется с репрессией транскрипции. Физически EZH2 взаимодействует с тремя типами DNMT и его мутации ведут к снижению триметилирования Н3К27 (и, возможно, метилирования ДНК) и к активации комплекса патогенных генов.
Мутации EZH2 достоверно ассоциированы с короткой общей выживаемостью в группе МДС низкого риска. Деацетилирование гистонов приводит к снижению транскрипционной активности. Поэтому некоторые из этих пациентов отвечают на эпигенетическую терапию, включающую гипометилирующие препараты (5-азацитидин и децитабин) и ингибиторы HDAC.
Ниже представлены наиболее частые мутации ведущих генов при миелодиспластических синдромах (табл. 34).
Таблица 34. Частота мутаций ведущих генов при миелодиспластических синдромах

Е.В. Зуховицкая, А.Т. Фиясь
Миелодиспластический синдром (МДС) - это диагноз рака. Является группой заболеваний, влияющих на кровь и мозг, различной степени тяжести, потребностей в лечении и продолжительности жизни.
Может быть первичным (самостоятельным) или следствием лечения рака. Первичная МДС не имеет очевидной причины. Связанная с лечением МДС имеет очевидную причину.
Как развивается миелодиспластический синдром?
ДНК (генетический материал) развивающиеся стволовые клетки в костном мозге повреждается. Это называется «приобретенной мутацией».
- Стволовые клетки образуют клетки крови (белые клетки, эритроциты и тромбоциты).
Это повреждение препятствует нормальному функционированию костного мозга. Когда костный мозг не работает должным образом, он не может производить достаточно здоровых клеток крови.
- Костный мозг производит недоразвитые (незрелые) клетки аномального размера, формы или внешнего вида, которые называются диспластическими (аномально сформированными) клетками.
- Может происходить скопление бластных клеток (незрелых клеток костного мозга), которые еще не могут выполнять специфическую функцию зрелой клетки.
- Костный мозг не может произвести достаточно здоровых эритроцитов, лейкоцитов или тромбоцитов.
В результате количество здоровых клеток крови (эритроцитов, лейкоцитов и тромбоцитов) обычно ниже нормы.
- - это состояние, когда в крови мало эритроцитов, что может вызвать усталость и .
- Нейтропения - это состояние, при котором мало белых клеток, поэтому иммунная система не может эффективно защитить себя от инфекции из-за недостатка нейтрофилов (типа белых клеток).
- - это состояние, при котором имеется небольшое количество тромбоцитов, которые могут вызвать кровотечение и легкие кровоподтеки без видимой причины.
- Панцитопения является состоянием, когда все три типа клеток в .
Тем не менее, нарушения в клетках костного мозга у пациентов с МДС варьируются от легких до очень тяжелых.
- У некоторых пациентов клетки МДС все еще могут функционировать и попадать в кровь. Эритроциты продолжают нести кислород, белые клетки (нейтрофилы и моноциты) поглощают и убивают бактерии и тромбоциты, приводящие к повреждению кровеносных сосудов.
- В более тяжелых случаях МДС, образование клеток крови является более беспорядочным, и аномальные бластные клетки (бласты) накапливаются в костном мозге и крови. Эти клетки не созревают в клетки, которые функционируют должным образом. Они не так способны, как нормальные клетки, созревать в эритроциты, нейтрофилы и тромбоциты.
- Обычно бласты составляют менее 5 процентов всех клеток в костном мозге. При миелодиспластическом синдроме бласты часто составляют более 5 процентов клеток в костном мозге. Количество бластов в организме является ключевым для определения степени тяжести МДС.
Причины и факторы риска
В большинстве случаев врачи не могут определить конкретную причину МДС. Миелодиспластический синдром может быть либо первичным, также известным как «de novo», когда причина неизвестна, либо вторичным, известным как «связанный с лечением». У большинства людей с МДС диагностируется первичный или миелодиспластическим синдромом de novo.
- Первичная или МДС de novo - болезнь не имеет известной причины. В большинстве случаев случайные мутации (изменения ДНК) накапливаются в стволовых клетках при старении, и если эти мутации происходят в определенных генах и в определенных местах, возникает МДС.
- Вторичная (связанная с лечением) МДС - некоторые люди, которые проходили лечение от другого рака, имеют небольшой риск развития связанной с лечением МДС. Это происходит только у небольшого числа пациентов, подвергшихся химиотерапии и/или лучевой терапии, и встречается реже, чем случаи первичной МДС. В целом, вероятность развития МДС в результате лечения другого рака очень низка. У некоторых пациентов с редкими наследственными заболеваниями костного мозга, такими как анемия Фанкони или врожденный дискератоз, также может развиться вторичная МДС, как и у пациентов, ранее диагностированных с другим расстройством недостаточности костного мозга, называемым апластической анемией.
Нет никакого способа предотвратить возникновение миелодиспластического синдрома, и вы не можете его подцепить или передать кому-либо.
Признаки и симптомы миелодиспластического синдрома
У некоторых пациентов могут отсутствовать симптомы заболевания. Миелодиспластический синдром может быть обнаружен до появления симптомов в результате лабораторных анализов, которые были частью обычного медицинского обследования.
Тем не менее, люди с МДС часто имеют низкий уровень одного или нескольких типов клеток крови. Уменьшение количества клеток крови ниже нормы называется цитопенией. Большинство симптомов миелодиспластического синдрома вызваны нехваткой эритроцитов, лейкоцитов или тромбоцитов в крови.
Анемия - это уменьшение количества здоровых эритроцитов. Эритроциты переносят кислород по всему организму. Анемия может вызвать такие симптомы, как
- усталость;
- головокружение;
- слабость;
- или дискомфорт в груди, особенно при физической нагрузке;
- бледность кожи (см. фото ниже).
Нейтропения - это уменьшение количества здоровых лейкоцитов. Белые клетки крови помогают организму бороться с инфекцией. Нейтропения может привести к частым или тяжелым инфекциям у пациентов.
Тромбоцитопения - это уменьшение количества здоровых тромбоцитов. Тромбоциты помогают контролировать кровотечение и участвуют в заживлении ран. Тромбоцитопения может вызвать такие симптомы, как
- синяки на теле;
- кровотечения и кровоподтеки (см. фото ниже).

Диагностика МДС
Точный диагноз - один из важнейших аспектов ухода за человеком. Получение точного диагноза поможет врачу:
- оцените, как болезнь будет прогрессировать;
- определить наиболее подходящее лечение.
Поскольку МДС может быть трудно диагностируемым заболеванием, вы можете получить второе медицинское заключение у опытного гематопатолога до начала лечения.
Диагностические критерии
Диагноз миелодиспластического синдрома требует, чтобы в костном мозге была обнаружена хотя бы одна из следующих характеристик:
- бласты, составляющие от 5 до 19 процентов клеток костного мозга;
- очевидные изменения в структуре или форме клеток костного мозга (дисплазия);
- цитогенетические нарушения (хромосомное повреждение ДНК в клетках):
- «простая» цитогенетика означает, что поражено менее трех хромосом;
- «комплексная» цитогенетика означает, что три или более хромосом поражены.
Следующие анализы и обследования помогут врачу поставить диагноз.
Анализы крови

ОАК с дифференциалом. Врач назначит общий (ОАК), который поможет измерить количество эритроцитов, лейкоцитов и тромбоцитов в крови. Эти измерения показывают степень, при которой клетки миелодиспластического синдрома в костном мозге влияют на нормальное развитие клеток крови.
Пациенты с МДС часто имеют небольшое количество одного или нескольких типов клеток крови. Общий анализ крови должен включать дифференциал , помогающий сравнить различные типы белых кровяных клеток в образце.
Низкое количество эритроцитов означает, что у вас анемия. Если у вас анемия, врач обследует ваши эритроциты, чтобы выяснить, вызвано ли ваше состояние миелодиспластическим синдромом или:
- низким содержанием железа, фолиевой кислоты или ;
- другой тип рака или проблемы с костным мозгом;
- еще одна причина анемии, например, .
Количество ретикулоцитов. Ретикулоциты - это клетки-предшественники (незрелые), которые развиваются в зрелые эритроциты. Количество ретикулоцитов измеряет количество ретикулоцитов в циркулирующей крови. Это может показать, как быстро эти клетки вырабатываются и высвобождаются костным мозгом и функционирует ли костный мозг должным образом. Когда у человека анемия, нормальным ответом является то, что костный мозг производит больше ретикулоцитов. Низкое количество ретикулоцитов указывает на то, что костный мозг работает плохо.
Анализ крови на эритропоэтин . Эритропоэтин - это вещество, вырабатываемое почками. Эритропоэтин стимулирует костный мозг производить больше эритроцитов. Анализ количества эритропоэтина в крови может помочь определить причину анемии.
Низкий уровень эритропоэтина может вызвать проблемы со здоровьем, кроме МДС. Низкий уровень эритропоэтина также может ухудшить анемию у человека с миелодиспластическим синдромом. Большинство пациентов с МДС, связанной с анемией имеют относительно низкие сывороточные уровни эритропоэтина.
Обследование костного мозга: аспирация и биопсия
Эти методы диагностики используются для подтверждения миелодиспластического синдрома. Обычно они проводятся одновременно в кабинете врача или в больнице. После того, как образцы взяты, патолог рассматривает образцы под микроскопом, чтобы оценить тип, размер, внешний вид и зрелость клеток.
- при аспирации костного мозга удаляется небольшое количество жидкого костного мозга изнутри кости.
- при биопсии костного мозга удаляет небольшой кусочек твердой кости вместе с небольшим количеством костного мозга.
Ниже приведены признаки миелодиспластического синдрома при обследовании:
- клетки аномального размера или формы (дисплазия);
- ненормальное количество (слишком много или слишком мало) клеток крови любого типа;
- увеличенное количество бластных клеток (незрелых клеток костного мозга);
- аномально низкое или высокое количество клеток в костном мозге;
- красные кровяные клетки, которые имеют слишком много или слишком мало железа.
Флуоресцентная гибридизация in situ, или метод FISH и кариотип
Эти методы обследования используются для идентификации клеток, которые содержат хромосомные аномалии. Исследования также могут помочь выявить аномальные клетки для диагностики заболевания, а также могут отслеживать и измерять результаты терапии. Хромосомные аномалии являются важными факторами при определении конкретных подтипов МДС, и иногда могут помочь врачам определить наиболее эффективный подход к лечению.
Цитогенетические аномалии.
Обычно клетки МДС имеют аномальные хромосомы. Приблизительно 50 процентов пациентов имеют один или несколько хромосомных дефектов. Существуют разные типы дефектов хромосом; например, часть хромосомы или вся хромосома может отсутствовать. Или может быть дополнительная копия хромосомы. Каждая хромосома делится на две секции, или «руки». Короткое плечо хромосомы обозначено как «p arm». Длинное плечо хромосомы обозначено «q arm».
Молекулярные генетические исследования
Эти обследования ищут мутации в генах, которые связаны с миелодиспластическим синдромом. Иногда результаты мутационного тестирования влияют на лечение МДС или его результаты. Молекулярное тестирование может быть сделано на образце крови или костного мозга. У некоторых пациентов с МДС он проводится для выявления генных аномалий.
Секвенирование ДНК - это тип молекулярного теста, который проверяет специфические генные мутации в раковых клетках. Определенные мутации связаны с лучшим или худшим исходом. Врачи используют результаты молекулярного тестирования, чтобы помочь планировать лечение.
Генетические мутации.
В последние годы исследования выявили несколько генных мутаций среди пациентов с МДС. Некоторые из этих мутаций могут оказывать влияние на исход заболевания.
Это заслуживает внимания, потому что:
- существует более 40 генов, которые могут быть видоизменены в миелодиспластический синдром;
- большое количество пациентов (более 80 процентов) могут иметь по крайней мере одну мутацию;
- основываясь на функциях этих мутированных генов, исследователи узнали о молекулярных механизмах, ответственных за развитие МДС;
- конкретный характер мутаций, наблюдаемый у пациентов с МДС, может частично объяснить изменчивость их заболевания и, вероятно, приведет к появлению более новых систем классификации, основанных на этих генетических отклонениях;
- подмножество мутаций может иметь прогностическое значение. Мутации в определенных генах ассоциировались как с лучшими, так и с худшими прогнозами, чем те, которые предсказаны Международной шкалой оценки прогноза (IPSS).
Подтипы миелодиспластического синдрома
Существует несколько видов (подтипов) МДС. Врачи классифицируют подтипы миелодиспластического синдрома в соответствии с различными факторами. Для их классификации врачи часто используют одну из двух систем: французскую, американскую, британскую (FAB (French-American-British) ) систему классификации или систему классификации Всемирной организации здравоохранения (ВОЗ) .
Классификация миелодиспластического синдрома значительно изменилась за последние несколько десятилетий. В 1982 году французско-американо-британская (FAB) рабочая группа разработала классификацию МДС. В 2001 году
Всемирная организация здравоохранения (ВОЗ) предложила альтернативную классификацию, которая была изменена по сравнению с первоначальным FAB и включала молекулярные и цитогенетические факторы. С тех пор классификация ВОЗ обновлялась дважды: один раз в 2008 году и еще раз в 2016 году.
Врачи также используют Международную шкалу оценки прогноза (IPSS) для более узкого определения степени тяжести заболевания, определения факторов риска для пациентов и планирования лечения.
FAB классификация
Классификация FAB разделила МДС на пять подтипов, основываясь на проценте бластов в костном мозге и периферической крови, количестве кольцевых сидеробластов (КС) и степени моноцитоза (повышенное количество лейкоцитов) следующим образом:
- Рефрактерная анемия (РА);
- Рефрактерная анемия с кольцевыми сидеробластами (РАКС);
- Рефрактерная анемия с избытком бластов (РАИБ);
- Рефрактерная анемия с избытком бластов в процессе трансформации ((РАИБ-Т);
- Хронический миеломоноцитарный лейкоз (ХММЛ).
Классификация ВОЗ
Текущие руководящие принципы классификации ВОЗ определяют 6 подтипов миелодиспластического синдрома на основе результатов анализа крови и костного мозга. Он классифицирует МДС по факторам, которые отличаются от факторов системы FAB:
- МДС с дисплазией одной линии:
- Рефрактерная анемия;
- Рефрактерная нейтропения;
- Рефрактерная тромбоцитопения.
- МДС с кольцевыми сидеробластами:
- Одноклеточная дисплазия;
- Многолинейная дисплазия.
- МДС с многолинейной дисплазией;
- МДС с избытком бластов:
- МДС с избытком бластов-1;
- МДС с избытком бластов-2.
- МДС с изолированной del (5q);
- МДС не не поддающееся классификации.
Международную шкалу оценки прогноза (IPSS)
Конкретные факторы могут повлиять на прогноз (вероятный исход) миелодиспластического синдрома (МДС) и помочь врачам определить, когда начинать лечение и насколько интенсивным должно быть лечение. Эти факторы включают:
- подтип МДСа;
- количество и тяжесть цитопений (низкое количество клеток крови);
- процент бластных клеток в костном мозге;
- тип и количество изменений хромосом.
Врачи используют эти прогностические факторы, чтобы назначить оценку и группу риска. Каждому прогностическому фактору присваивается число в зависимости от его серьезности. Более низкий балл обычно указывает на лучший прогноз. Баллы по всем факторам затем складываются, чтобы создать общую оценку риска.
Оценка риска описывает , насколько быстро заболевание может прогрессировать, и используется для отнесения пациента к определенной группе риска. Врачи используют информацию о группе риска пациента, чтобы выбрать подход к лечению.
Существует три основных прогностических системы оценки:
- шкала IPSS (International Prostate Symptom Score Международную шкалу оценки прогноза);
- прогностическая шкала IPSS-R (пересмотренная международная система прогностической оценки);
- шкала WPSS (система прогнозной оценки, основанная на классификации ВОЗ).
Первая - это наиболее часто используемая прогностическая система оценки. IPSS использует три «прогностических показателя» для прогнозирования течения заболевания пациента:
- процент лейкозных бластных клеток в костном мозге;
- тип хромосомных изменений, если таковые имеются, в клетках костного мозга (цитогенетика);
- наличие одного или нескольких клеток крови с низким содержанием (цитопения).
Низкие и промежуточные категории иногда объединяются в группу низкого риска; промежуточные 2 и высокие категории иногда объединяются в группу более высокого риска.
Второй IPSS -, известный как «IPSS-R», охватывает те же факторы заболевания, что и IPSS, но эти факторы определены более детально. IPSS-R показывает пять факторов заболевания:
- бластные клетки;
- цитогенетику;
- гемоглобин;
- абсолютное количество нейтрофилов;
- количество тромбоцитов.
Третий - WPSS используется не так часто, как IPPS и IPSS-R. Он отличается от двух других систем тем, что включает подтип миелодиспластического синдрома в качестве прогностического фактора. Он также назначает оценку на основе наличия или отсутствия тяжелой анемии.
Группы риска
Перед началом лечения врачи группируют состояние пациента в одну из двух категорий риска: МДС «с низким риском» или «с высоким риском». Каждая категория включает в себя определенные группы риска от каждой из систем оценки.
Важно отметить, что прогностические системы и группы риска не предсказывают, как МДС будет реагировать на лечение, а вместо этого они подскажут, как МДС, вероятно, будет вести себя со временем без лечения.
МДС с меньшим риском имеет тенденцию расти и прогрессировать медленно. Она может не вызывать много или даже серьезных симптомов в течение длительного времени. Следовательно, часто используется менее интенсивное лечение. Напротив, миелодиспластический синдром с более высоким риском может прогрессировать быстрее или превратиться в острый миелоидный лейкоз без лечения, что может вызвать больше симптомов и осложнений со здоровьем за короткое время. Таким образом, часто требуется более интенсивная терапия.
Лечение миелодиспластического синдрома
Положение каждого пациента должно оцениваться индивидуально гематологом-онкологом, который специализируется на лечении МДС и который обсудит с пациентом подтип заболевания, прогностические факторы и варианты лечения. Также важно обратиться за лечением в центр, который имеет опыт лечения миелодиспластического синдрома.
Типы лечения МДС
Врачи используют несколько типов подходов и комбинаций лечения МДС:
- поддерживающая терапия:
- переливания крови;
- хелатная терапия железом;
- факторы роста клеток крови;
- медикаментозная терапия:
- аллогенная трансплантация стволовых клеток.
Также врач может предложить принять участие в клиническом испытании. Клинические испытания могут включать терапию новыми препаратами и новыми комбинациями лекарств или новыми подходами к трансплантации стволовых клеток.
В поисках лучшего подхода к лечению
- находитесь ли вы в категории низкого или высокого риска;
- подтип вашего МДС;
- общее состояние здоровья;
- другие болезни, которые у вас могут быть, называемые сопутствующими заболеваниями, такие как болезни сердца, или .
Поскольку МДС с меньшим риском прогрессирует медленнее, обычно в первую очередь используются низкоинтенсивное лечение. Цели для пациентов с МДС с низким риском:
- улучшить показатели крови;
- уменьшите потребность в переливаниях крови;
- снизить риск заражения;
- улучшить качество жизни.
МДС с высоким риском имеет тенденцию быстро расти и прогрессировать в острый короткие сроки. По этой причине обычно используются более интенсивные методы лечения. Цели для пациентов с МДС высокого риска:
- замедлить или остановить прогрессирование миелодиспластического синдрома до острого миелоидного лейкоза;
- увеличить продолжительность жизни.
Возможно, вам будет полезно пригласить любимого человека к себе на прием к врачу, а также делать записи и задавать дополнительные вопросы. Хорошей идеей будет подготовить вопросы, которые вы хотели бы задать, посетив врача. Вы также можете записывать разговор с врачом и более внимательно прослушать, когда вернетесь домой.
Поддерживающая терапия
Лечение, проводимое для облегчения симптомов заболевания и побочных эффектов терапии, называется поддерживающим лечением . Цель поддерживающего лечения - улучшить качество жизни пациента и максимально уменьшить дискомфорт. Поддерживающий уход является важной частью лечения МДС.
Переливания крови
Переливание эритроцитов может помочь некоторым пациентам, улучшив их количество в крови или сняв симптомы анемии, такие как одышка, головокружение, сильная усталость и боль в груди. Переливание может помочь облегчить симптомы на короткое время, но со временем может потребоваться больше переливаний.
При МДС от 60 до 80 процентов пациентов страдают анемией на момент постановки диагноза, и до 90 процентов пациентов нуждаются в одном или нескольких переливаниях в течение всей болезни.
Переливание тромбоцитов может использоваться у пациентов с тромбоцитопенией (низким количеством тромбоцитов), которая может вызывать такие симптомы, как легкие кровоподтеки или кровотечение. Переливание крови обычно требуется, когда количество тромбоцитов у пациента падает ниже 10000/мкл.
Аминокапроновая кислота, антифибринолитическое средство, рекомендуется при кровотечениях, которые не реагируют на переливание тромбоцитов, и в случаях тяжелой тромбоцитопении. Это лекарство работает, предотвращая слишком быстрое разрушение сгустков крови.
Хелатная терапия железом
Железо содержится в эритроцитах. Когда человек получает большое количество переливаний эритроцитов, слишком много железа может накапливаться в организме. Это называется передозировка железом, и со временем она может повредить жизненно важные органы.
При хелатной терапии железом применяются препараты, называемые «хелаторами », которые связывают избыток железа и выводят его из организма. Эта терапия может быть подходящей для пациентов с анемией, которые нуждаются в частых переливаниях крови (более 4 единиц эритроцитов в течение 8 недель). Наиболее распространенные препараты, используемые при этой терапии, включают:
- Деферазирокс (Эксиджад®);
- Дефероксамина мезилат (Десферал®).
Для пациентов, которым необходимо частое переливание эритроцитов, рекомендуется, чтобы врачи следили за уровнем ферритина (железа) в сыворотке и часто проверяли наличие признаков повреждения органов.
Факторы роста клеток крови
Агенты, называемые «факторами роста», способствуют выработке клеток крови в костном мозге. Эти агенты используются для лечения некоторых пациентов, у которых количество клеток крови уменьшено.
Факторы роста красных кровяных клеток.
Эритропоэтин (ЭПО) - это гормон, созданный в почках. Он стимулирует выработку эритроцитов в ответ на низкий уровень кислорода в организме. Нехватка ЭПО также может вызвать анемию.
Стимуляторы эритропоэза - это факторы роста эритроцитов, которые являются фармацевтическими аналогами природного ЭПО. Они используются для пациентов с МДС, у которых анемия связана с низким уровнем ЭПО. Лечение с помощью стимуляторов эритропоэза может снизить потребность в переливании крови и, возможно, улучшить выживаемость.
- Эпоэтин альфа (Эпокрин®) и дарбэпоэтин альфа (Аранесп®) являются типами стимуляторов эритропоэза. Их назначают инъекцией под кожу. Дарбепоэтин альфа является более длительно действующей формой ЭПО, чем дарбэпоэтин альфа.
Большинство пациентов с МДС не имеют низких уровней ЭПО, поэтому введение стимуляторов не является полезным лечением их анемии. Тем не менее, все пациенты с миелодиспластическим синдромом должны проверить уровень ЭПО.
Некоторые пациенты с МДС и низким уровнем ЭПО могут не получать пользу от терапии только стимуляторами; однако стимуляторы эритропоэза, данный вместе с Г-КСФ, может увеличить концентрацию гемоглобина (см. ниже).
Факторы роста лейкоцитов.
Факторы роста лейкоцитов естественным образом вырабатываются организмом и помогают увеличить выработку лейкоцитов. Синтетические версии этих веществ могут быть использованы для лечения пациентов с частыми инфекциями, вызванными нейтропенией, но они, как известно, не помогают пациентам жить дольше.
- Гранулоцитарный колониестимулирующий фактор (Г-КСФ), который помогает организму увеличить производство лейкоцитов. Филграстим (Нейпоген®) и Пегфильграстим (Неуластим®) являются примерами препаратов Г-КСФ.
- Гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) помогает организму вырабатывать много разных типов лейкоцитов. Сарграмостим (Лейкин®) является препаратом ГМ-КСФ.
Факторы роста тромбоцитов.
Тромбопоэтин (ТПО) - это вещество, которое помогает организму вырабатывать тромбоциты.
- Ромиплостим (Энплейт®) и элтромбопаг (Револейд®) являются препаратами, которые действуют как TPO. Эти агенты исследуются в качестве лечения пациентов с миелодиспластическим синдромом, у которых низкий уровень тромбоцитов. В настоящее время эти препараты одобрены FDA для (низкое количество тромбоцитов) у пациентов с хронической (ИТП) и имеющих недостаточный ответ на кортикостероиды, иммуноглобулины или спленэктомию.
- Хотя ромиплостим и элтромбопаг не одобрены специально для лечения МДС, иногда они могут быть полезны пациентам с очень низким количеством тромбоцитов.
Управление инфекциями
Низкое количество лейкоцитов может увеличить риск заражения. В некоторых случаях инфекция может быть частой или тяжелой. Команда по лечению будет уделять пристальное внимание любой инфекции или необъяснимой лихорадке. Если идентифицирована или подозревается бактериальная инфекция, могут назначить антибиотики. Антивирусные препараты могут использоваться для лечения определенных вирусных инфекций.
Химиотерапия и медикаментозная терапия

Существует много разных видов лекарств, используемых при лечении миелодиспластического синдрома:
Гипометилирующие агенты
Препараты с меньшей вероятностью вызывают серьезные побочные эффекты и часто назначаются амбулаторно. Для лечения МДС утверждены два препарата для химиотерапии низкой интенсивности:
- Азацитидин (Видаза®);
- Децитабин (Дакоген®).
Иммунодепрессивная терапия
Этот тип терапии использует лекарства, которые подавляют определенные части иммунной системы. Например, при некоторых типах МДС лимфоциты могут поражать костный мозг, что приводит к тому, что он перестает вырабатывать достаточно здоровых клеток крови. Основными препаратами иммунодепрессивной терапии, используемыми для лечения МДС, являются:
- Антитимоцитарный глобулин (АТГ [Тимоглобулин®]);
- Циклоспорин (Неорал®);
- Такролимус (Програф®).
Этот тип терапии не подходит для всех типов МДС; оно наиболее эффективно, когда миелодиспластический синдром обладает функциями, связанными с атакой иммунной системы, такими как:
- наличие белка HLA-DR15;
- низкое количество клеток в костном мозге;
- младшие пациенты с МДС низкого риска.
Иммуномодуляторы
Иммуномодуляторы модифицируют различные части иммунной системы. Следующее лекарственное средство одобрено для лечения МДС низкого риска с удалением 5q :
- Леналидомид (Ревлимид®).
Лечение этим препаратом может снизить необходимость переливания эритроцитов у некоторых пациентов.
Высокоинтенсивная терапия
Этот тип терапии включает в себя использование препаратов интенсивной химиотерапии или трансплантации стволовых клеток. Высокоинтенсивная химиотерапия включает лекарственные препараты и схемы лечения, обычно используемые для лечения ОМЛ (острый миелоидный лейкоз).
Поскольку эти агенты имеют тенденцию вызывать более серьезные побочные эффекты, они обычно используются только для МДС, который может прогрессировать до острого миелоидного лейкоза (заболевание высокого риска). Пациентам с МДС в промежуточной категории – 2 и IPSS высокого риска может потребоваться лечение с помощью высокоинтенсивной химиотерапии. Используемые лекарства могут включать
- Цитарабин (Цитозина арабинозид, Цитозар®);
- Идарубицин;
- Даунорубицин (Церубидин®);
- Митоксантрон (Новантрон®).
Химиотерапия может проводиться отдельно или в комбинации двух или трех различных препаратов (комбинированная химиотерапия). При лечении комбинированной терапией:
- могут быть использованы низкие дозы препаратов;
- количество клеток крови пациента может ухудшиться. Если количество клеток ухудшается, врач оценит состояние пациента, чтобы решить, можно ли продолжать интенсивную химиотерапию.
Ингибиторы тирозинкиназы
Ингибиторы тирозинкиназы - это лекарства, которые нацелены на аномальные белки, вызывающие неконтролируемый рост клеток. Следующее лекарственное средство одобрено для взрослых пациентов с миелодиспластическими синдромами/миелопролиферативными новообразованиями (МДС/МПН), связанными с перестройками генов PDGFR (тромбоцитарного фактора роста):
- Иматиниба мезилат (Гливек®).
Аллогенная трансплантация стволовых клеток
Аллогенная трансплантация стволовых клеток используется иногда для лечения пациентов с МДС. Однако из-за высокого и часто опасного для жизни риска, связанного с трансплантацией стволовых клеток, это лечение в основном рассматривается для:
- пациентов моложе 60 лет;
- пациентов до 75 лет, у которых хорошее здоровье;
- пациентов, которые относятся либо к промежуточному классу IPSS – 2, либо к категории высокого риска IPSS, либо имеют (вторичную) МДС, связанную с терапией рака в прошлом;
- пациентов, у которых есть донор стволовых клеток, сопоставленный с лейкоцитарным антигеном (HLA) человека (одноуровневое или несвязанное совпадение).
Аллогенные трансплантации стволовых клеток могут также рассматриваться для выборочных пациентов с МДС низкого риска с тяжелой цитопенией. Аутологичная трансплантация с использованием собственных стволовых клеток пациента используется при некоторых других заболеваниях, но не применяется при миелодиспластическом синдроме, поскольку собственные стволовые клетки пациента являются ненормальными из-за заболевания.
Прививка против болезни хозяина. Серьезным риском аллогенной трансплантации стволовых клеток является болезнь “трансплантат против хозяина “, которое развивается, если иммунные клетки донора атакуют вашу нормальную ткань. Побочные эффекты этой болезни могут варьироваться от незначительных до угрожающих жизни.
Трансплантация аллогенных стволовых клеток пониженной интенсивности
Пациенты, которые не переносят аллогенную трансплантацию с помощью высокоинтенсивной химиотерапии, могут иметь право на трансплантацию стволовых клеток пониженной интенсивности (иногда называемую немиелоабляционным трансплантатом ).
При таком типе трансплантации пациенты получают более низкие дозы химиотерапевтических препаратов и/или облучения. Они получают иммунодепрессанты для предотвращения отторжения трансплантата (донорских клеток), чтобы иммунные клетки донора могли атаковать раковые клетки. Эту атаку называют эффект “трансплантат против лейкоза” (ТПЛ).
Исследования изучают возможность использования этого типа трансплантата у пожилых людей с рецидивом и/или с рефрактерным заболеванием. Трансплантация стволовых клеток пониженной интенсивности обычно используется пациентам старше 55–60 лет.
Вакцинотерапия
В настоящее время проводятся клинические испытания для определения эффективности вакцины против миелодиспластического синдрома при лечении пациентов с МДС высокого риска. Вакцина изготовлена из белковых строительных блоков, называемых «пептидами», которые могут помочь организму создать эффективный иммунный ответ против клеток МДС.
Последующий уход за больными после лечения
Нужно будет регулярно посещать своих врачей. Врач оценит состояние пациента, количество клеток крови и, возможно, состояние костного мозга.
Возможно, придется повторить некоторые тесты, чтобы узнать, получает ли пациент пользу от лечения и стоит ли продолжать её.
Высшее образование (Кардиология). Врач-кардиолог, терапевт, врач функциональной диагностики. Хорошо разбираюсь в диагностике и терапии заболеваний дыхательной системы, желудочно-кишечного тракта и сердечно-сосудистой системы. Закончила академию (очно), за плечами большой опыт работ.Специальность: Кардиолог, Терапевт, Врач функциональной диагностики. .
МИЕЛОДИСПЛАСТИЧЕСКИЕ СИНДРОМЫ:
механизмы развития, симптомы, лечение
Что такое МДС?
Миелодиспластические синдромы (МДС) представляют собой группу заболеваний с первичным поражением костного мозга, проявляющихся в том, что костный мозг не вырабатывает достаточного количества здоровых клеток крови.
Миелодиспластическими синдромами страдают, главным образом, пожилые люди (возраст большинства больных от 60 до 85 лет), однако ими могут заболеть и люди более молодого возраста (от 30 лет). По типам МДС различаются на первичные (идиопатические) – 80-90% случаев, вторичные (вследствие предшествующей химиотерапии и др. факторов) – 10-20%. Спорадические, фамильные – редко встречаются, но в этом случае надо исключать анемию Фанкони или др. варианты фенотипа с мутаторными генами. 5-летняя выживаемость при МДС не превышает 60%.
За небольшими исключениями, причины возникновения МДС неизвестны. У некоторых людей описан врожденный МДС. Если такой внешний фактор установить невозможно, то заболевание называют «первичным МДС».
Факторами риска первичного МДС считаются контакт с токсинами (бензин, органические растворители, пестициды), ионизирующее излучение, курение, врожденные и наследственные заболевания (анемия Фанкони, тяжелая врожденная нейтропения, синдром Швахмана-Даймонда, анемия Даймонда-Блэкфана), пожилой возраст. Вторичный МДС может развиваться после предшествующей химиотерапии онкологического заболевания (лимфома Ходжкина, рак молочной железы и др.) или после трансплантации клеток крови в результате мутагенного воздействия ряда лекарственных препаратов (мехлоретамин, прокарбазин, хлорамбуцил и др.).
Убедительных данных, свидетельствующих о том, что МДС могут вызывать какие-либо вирусы, отсутствуют, поэтому МДС не может передаваться окружающим людям. Поскольку члены семьи не находятся в группе повышенного риска, они не должны проходить дополнительное обследование.
МДС развивается в результате нарушения нормальной деятельности костного мозга.
Основной функцией костного мозга является выработка клеток крови, к которым относятся эритроциты, тромбоциты и лейкоциты. Каждая из этих клеток после выхода из костного мозга выполняет важные, сохраняющие жизнь, функции. От них зависит обеспечение тканей и органов кислородом (эритроциты), остановка кровотечения (тромбоциты) и защита от инфекций (лейкоциты). В здоровом костном мозге находятся незрелые клетки крови, называемые стволовыми клеткам или клетками-предшественниками которые, по мере необходимости превращаются в зрелые эритроциты, лейкоциты и тромбоциты, выполняющие свои функции.
При МДС эти стволовые клетки могут не достигать зрелости и (или) иметь сокращенный жизненный цикл, погибая в костном мозге до своего выхода в кровь, что приводит к уменьшению количества зрелых циркулирующих клеток крови (так называемая цитопения) и, соответственно, снижению их функции. Кроме того, зрелые клетки крови, циркулирующие в периферической крови, могут неправильно функционировать из-за, так называемой, дисплазии - аномалиях формы или морфологии клеток крови, находящихся в костном мозге и/или периферической крови.
Неспособность костного мозга вырабатывать здоровые зрелые клетки возникает постепенно, а потому пациенты могут длительно страдать от последствий заболевания, таких как анемия, кровоточивость и сниженная сопротивляемость инфекциям. Кроме того, у 30% пациентов МДС может развиваться острый миелоидный лейкоз (ОМЛ).
Клинические проявления МДС
Многие больные на ранних стадиях заболевания не испытывают никаких симптомов, т.к. в крови находится достаточное количество зрелых клеток. Одним из самых характерных симптомов в начале болезни является анемия (пониженное количество эритроцитов, гемоглобина и гематокрита).
Больные, страдающие анемией, обычно испытывают постоянное чувство усталости, слабость, снижение работоспособности, неспособность к концентрации внимания. Лучше переносят анемию женщины, чем мужчины. По мере нарастания анемии присоединяется учащение сердцебиения, затруднение дыхания, сонливость, головокружение. Возможно развитие обмороков. Особенно тяжело анемию переносят пожилые пациенты и люди с заболеваниями сердца и легких: у них может развиться стенокардия (боли в области сердца), инфаркт миокарда, нарасти одышка, снизиться переносимость физических нагрузок, могут развиться нарушения ритма сердца.
При поражении сосудов нижних конечностей усиливаются проявления так называемой перемежающей хромоты (появления болей в ногах при ходьбе на небольшие расстояния). Поэтому часто об изменениях в анализах крови узнают во время обследования по поводу терапевтической патологии .
Часто больные проходят лечение анемии под наблюдением терапевта, который использует с этой целью препараты железа, витамин В12, фолиевую кислоту, но не достигает успеха, т.е. анемия является «рефрактерной» (устойчивой) к этим стандартно применяемым препаратам, что может послужить поводом для консультации врача-гематолога.
Анемия может сопровождаться снижением количества нейтрофилов (нейтропения) и тромбоцитов (тромбоцитопения). Низкое количество лейкоцитов в крови (норма от 4000 до 10000 лейкоцитов в 1 микролитре крови) снижает сопротивляемость организма, прежде всего, к бактериальной инфекции. Больные нередко страдают рецидивирующими кожными инфекциями, инфекциями уха, горла и носа, бронхо-легочным инфекциям (бронхиты, пневмонии) и инфекциями мочевыводящих путей, полости рта (стоматиты) и зубов, сопровождаемые повышением температуры.
При тромбоцитопении (нормальное содержание в крови от 130000 до 450000 тромбоцитов в 1 микролитре крови) у больных отмечается повышенная кровоточивость со склонностью к образованию синяков и возникновение кровотечений даже в результате незначительных ударов и царапин. Для остановки кровотечения даже при небольших порезах может требоваться больше времени, чем обычно. Тяжелая тромбоцитопения, что наблюдается в редких случаях, наступает при уменьшении числа тромбоцитов ниже уровня 20 000 в 1 мкл или 20х10 9 /л и сопровождается кровотечениями.
Кровоподтеки могут быть значительными, некоторые размером с ладонь. Нередкими являются носовые кровотечения, и больные жалуются на кровоточивость десен, например, во время стоматологических процедур, а у женщин могут отмечаться более обильные менструальные кровотечения.
Пациенту с МДС рекомендуется консультироваться с врачом-гематологом прежде, чем обратиться за стоматологической помощью, учитывая риск возникновения кровотечений и инфекций. Более того, по показаниям могут быть назначены лекарственные препараты (профилактический прием антибиотиков, др.).
Диагностика МДС
1.Первым шагом в диагностике МДС является проведение клинического анализа крови путем взятия пробы крови из вены. В пробе крови определяется количество клеток крови (эритроцитов, лейкоцитов и их подтипов, а также тромбоцитов), форма и размер эритроцитов и лейкоцитов.
2. Для исключения наиболее часто встречающихся анемий проводят исследование сыворотки крови, где определяют уровень железа и ферритина (оценка запасов железа в организме), витамина В 12 и фолиевой кислоты, эритропоэтина (белок, который вырабатывается в почках в ответ на низкий уровень содержания кислорода в тканях организма, стимулирует образование эритроцитов в костном мозге).
3.Если причина поражения костного мозга признается вероятной, показано проведение исследования костного мозга. Исследование костного мозга включает исследование аспирата костного мозга (анализ миелограммы, цитологическое исследование), получаемого путем взятия пробы жидкого костного мозга, и трепанобиоптата костного мозга (пробы костной составляющей костного мозга).
В процессе исследования костного мозга определяются:
1) процентное содержание бластов и клеток с признаками дисплазии;
3) хромосомные аномалии, как например, отсутствующие или дополнительные хромосомы в клетках костного мозга. Любые аномалии описываются в отчете о результатах гематологического исследования, а хромосомные аномалии (отсутствие или делеция хромосом, а также наличие измененных или дополнительных хромосом или частей хромосом) включаются в отчет о результатах цитогенетического исследования. В дальнейшем у больных МДС проводятся повторные исследования костного мозга для того, чтобы определить клинический статус МДС с течением времени (ремиссия, стабилизация, прогрессия) и оценить эффект проводимой терапии.
Определение степени тяжести МДС у человека.
На основании полученной информации не только устанавливается диагноз МДС, но и определяется подтип болезни и прогноз течения у конкретного пациента. Для этого разработаны различные системы классификации. Согласно последней из предложенных классификаций, известной под названием «Классификация Всемирной организации здравоохранения (ВОЗ)», существует шесть различных подтипов МДС, разделение которых основано на анализе крупных международных баз данных и на лучшем понимании процессов течения болезни.
В прошлом широко применялась франко-американо-британская система классификации (ФАБ-классификация). Некоторые гематологи продолжают пользоваться этой системой и в настоящее время.
ФАБ-классификация была разработана в начале 80-х годов прошлого века группой врачей из Франции, Соединенных Штатов Америки и Великобритании, специализировавшихся на диагностике МДС. Основным критерием в данной классификации являлось процентное содержание бластных клеток в костном мозге, при этом процентное содержание этих клеток менее 2% считалось нормальным для здорового костного мозга. Согласно ФАБ-классификации различаются следующие пять подтипов МДС:
· рефрактерная анемия (РА);
· рефрактерная анемия с кольцевыми сидеробластами (РАКС);
· рефрактерная анемия с избытком бластов (РАИБ);
· рефрактерная анемия с избытком бластов в трансформации (РАИБ-Т);
· хронический миеломоноцитарный лейкоз (ХММЛ).
Система классификации ВОЗ для МДС у взрослых больных сохраняет некоторые элементы системы ФАБ-классификации и расширяет категории подтипов МДС. Основные характеристики шести подтипов МДС, различаемых системой классификации ВОЗ, освещены в приведенной ниже таблице.
Заслуживающие внимания изменения в системе классификации ВОЗ, по сравнению с системой ФАБ-классификации, заключаются в следующем:
· разделение подтипа РАИБ на два подтипа;
· исключение ХММЛ как самостоятельного подтипа;
· включение МДС с хромосомной аномалией «синдром 5 q -» как отдельного подтипа;
· исключение подтипа рефрактерная анемия с избытком бластов в трансформации (РАИБ-Т), который в настоящее время рассматривается как подлежащий включению в ОМЛ;
· введение категории «МДС неклассифицируемый».
Рефрактерная анемия (РА). Больные этой категории страдают анемией, которая не отвечает на лечение препаратами железа или витаминами, то есть является рефрактерной по отношению к такому лечению. Анемия может сопровождаться тромбоцитопенией и нейтропенией легкой или средней тяжести.
Рефрактерная анемия с кольцевыми сидеробластами (РАКС). У больных с данным видом анемии отмечается дисплазия только в эритроидном ряду. Сидеробласты – это клетки эритроидного ряда, содержащие гранулы железа; кольцевые сидеробласты являются аномальными. Рефрактерная анемия с кольцевыми сидеробластами или без них (РАКС) считается наиболее доброкачественным подтипом в системе классификации ВОЗ.
Рефрактерная цитопения с мультилинейной дисплазией (РЦМД). В эту категорию включаются больные, страдающие рефрактерной цитопенией (устойчивым низким количеством клеток крови какого-либо типа, например, рефрактерной нейтропенией или рефрактерной тромбоцитопенией) и имеющие минимальную дисплазию, по меньшей мере, в двух типах клеток крови, а также количество бластов 5% и менее, либо количество кольцевых сидеробластов менее 15%. Если количество кольцевых сидеробластов у больного с РЦМД превышает 15%, ставится диагноз РСМД-КС.
|
ВОЗ-классификация МДС |
|
|
Подтип МДС |
Характеристика |
|
РА |
Минимальная дисплазия в одном типе клеток крови (красных кровяных тельцах или эритроцитах) и < 5% бластов в костном мозге |
|
РАКС |
Дисплазия только эритроидного ростка и > 15% кольцевых сидеробластов |
|
РЦМД |
Дисплазия (> 10%) в двух или трех типах клеток крови, < 5% бластов и < 15% кольцевых сидеробластов в костном мозге (количество кольцевых сидеробластов > 15% называется РЦМД-КС) |
|
РАИБ |
|
|
РАИБ 1 |
Количество бластов в костном мозге от 5% до 9% |
|
РАИБ 2 |
Количество бластов в костном мозге от 10% до 19% |
|
МДС/МПЗ |
Дисплазия при наличии характеристик, обычно присущих миелопролиферативному заболеванию; включает ХММЛ |
|
Синдром 5 q - |
Больные, у которых отсутствуют хромосомные аномалии, за исключением делеции в длинном плече 5-й хромосомы |
|
МДС неклассифицируемый |
Включает больных с цитопенией в одном типе клеток крови, кроме анемии (то есть, с нейтропенией или тромбопенией) и какими-либо необычными характеристиками (например, фиброзом костного мозга) |
Рефрактерная анемия с избытком бластов (РАИБ). Эта категория делится на две подкатегории, которые различаются количеством бластов в костном мозге. У больных, имеющих РАИБ-1, количество бластов составляет от 5% до 9%, а у больных с РАИБ-2 – от 10% до 19%.
Миелодиспластический синдром/миелопролиферативное заболевание (МДС/МПЗ). Больные с МДС/МПЗ включают тех, которые страдают хроническим миеломоноцитарным лейкозом (ХММЛ), который является отдельной категорией в системе ФАБ-классификации.
5 q - (5 q минус) синдром. Синдром 5 q -, в настоящее время выделяемый в отдельный подтип МДС, впервые был описан более 30 лет тому назад. Название этого синдрома связано с хромосомой номер 5, а именно с хромосомной аномалией (делецией) в длинном плече (q ) хромосомы 5. Делеция в пределах длинного плеча хромосомы N о 5 является единственной хромосомной аномалией у больных МДС с диагнозом «синдром 5 q -».
Обычно этот синдром наблюдается у женщин среднего возраста, как правило, в возрасте 65 лет, и сопровождается анемией легкой или средней тяжести, низким количеством лейкоцитов (лейкопения) и зачастую нормальным или повышенным количеством тромбоцитов. Синдром 5 q - характеризуется благоприятным прогнозом, длительностью жизни более пяти лет со времени постановки диагноза (критерий, принятый в медицине для оценки тяжести заболевания).
Неклассифицируемый МДС. Данная категория включает больных с цитопенией в одном типе клеток крови (например, тромбопенией или нейтропенией) и какими-либо необычными характеристиками (например, фиброзом костного мозга), не более 1%- 2% всех случаев МДС.
Еще одной системой, используемой для характеристики активности МДС и составления прогноза для пациента, является Международная прогностическая балльная система ( IPSS ).
Для оценки степени тяжести МДС используется Международная прогностическая балльная система (IPSS ), заболевание оценивается в баллах, исходя из опасности, которую оно представляет для больного, то есть времени вероятного прогрессирования болезни или ее трансформации в ОМЛ. Прогностический балл определяется на основании процентного содержания бластов, присутствующих в костном мозге, результатов цитогенетического исследования, а также показателей количества клеток крови и других результатов анализа крови.
Прогностический балл определяется путем сложения индивидуальных балов по процентному содержанию бластов, по результатам цитогенетического исследования и анализов крови и используется для оценки исхода болезни для больного МДС. Прогностический балл показывает, к какой из групп риска относится больной.
|
Определение прогностического балла Прогностический балл: сумма индивидуальных баллов по бластам, результатам цитогенетического исследования и результатам анализа крови |
|
|
Процентное содержание бластов в костном мозге |
Балл |
|
5% и менее |
|
|
5-10% |
|
|
11-20% |
|
|
21-30% * |
2 , 0 |
|
Результаты цитогенетического исследования ** |
|
|
хорошие |
|
|
промежуточные |
|
|
плохие |
|
|
Уровень цитопений по результатам анализа крови *** |
|
|
0 или 1 цитопении |
|
|
2 или 3 цитопении |
|
|
* Больным, в костном мозге которых содержится более 20% бластов, устанавливают диагноз острого миелоидного лейкоза (ОМЛ). ** Прогностически хорошие результаты означают нормальный набор из 23 пар хромосом или набор, в котором имеется только частичная потеря длинного плеча хромосомы N о 5. К промежуточным относятся все результаты, которые не попадают под определение «хорошие» или «плохие». Прогностически плохие результаты включают потерю одной из двух хромосом N о 7 (моносомия 7), добавление третьей хромосомы N о 8 (трисомия 8), либо три и более аномалий. *** Уровень цитопений по результатам анализа крови определяется следующим образом: нейтрофилы < 1,800 на 1 микролитр крови; гематокрит < 36% эритроцитов в общем объеме крови в организме; тромбоциты < 100,000 на 1 микролитр крови. |
|
Лечение МДС
Целями лечения являются восстановление показателей периферической крови, уменьшение клинических проявлений МДС, снижение зависимости от переливаний компонентов крови, отсрочка трансформации в ОМЛ, увеличение продолжительности жизни, улучшение качества жизни пациентов.
Методы лечения пациентов с МДС зависят от типа заболевания, прогностических факторов, возраста больного, а также сопутствующей патологии и могут подразделяться на потенциально излечивающие терапевтические методы и поддерживающую терапию.
Поддерживающая и симптоматическая терапия
Основу лечения МДС составляет поддерживающая терапия, которая включает применение ростовых факторов, лечение интеркуррентных инфекций и заместительную терапию компонентами крови.
Одним из аспектов поддерживающей терапии пациентов с МДС является применение гемопоэтических ростовых факторов, которые воздействуют на костный мозг, усиливая продукцию одного или нескольких ростков кроветворения. В последние годы появилось несколько человеческих рекомбинантных ростовых факторов, включающих эритропоэтины (ЭПО: эпоэтины α и β, дарбепоэтин), гарнулоцитарные и гранулоцитарно-макрофагальные колониестимулирующие факторы (Г-КСФ и ГМ-КСФ: филграстим, молграмостим), агонисты тромбопоэтиновых рецепторов (ромиплостим, элтромбопаг), которые стимулируют выработку эритроцитов, гранулоцитов и тромбоцитов соответственно. На лечение ростовыми факторами, приводящее к снижению необходимости в заместительной терапии, отвечают только 20-30% пациентов с МДС. Прогностическими факторами ответа на терапию являются исходный уровень ЭПО, выраженность трансфузионной потребности, длительность заболевания, тип заболевания по классификации FAB или ВОЗ, группа риса по шкале IPSS .
Несмотря на то, что стоимость терапии гемопоэтическими факторами роста в 3-4 раза превышает стоимость трансфузионной терапии, первая остается предпочтительным видом лечения. Успешное лечение гемопоэтическими ростовыми факторами позволяет избежать или, в некоторых случаях, снизить потребность в многократных трансфузиях компонентов крови и сопутствующий риск перегрузки железом.
В основе поддерживающей терапии пациентов с МДС лежит заместительная терапия компонентами крови. У пациентов с низким риском развития ОМЛ анемия может быть основной клинически значимой проблемой. Заместительная терапия облегчает симптомы анемии и, следовательно, является важным методом лечения. Частота переливаний зависит от состояния больного, тяжести анемии, а также сопутствующей патологии. Некоторые больные могут нуждаться в переливаниях эритроцитарной массы каждые одну-две недели, в то время как другим может быть достаточно всего лишь одного переливания каждые шесть-двенадцать недель. Результатом заместительной терапии является повышение уровня гемоглобина, которое, как показывают исследования, имеет положительную корреляцию с показателем качества жизни. Переливание тромбоцитарной массы проводятся редко и только в тех случаях, когда количество тромбоцитов крайне низкое и/или имеются опасные для жизни кровотечения. Однако преимущества трансфузионной терапии следует сопоставлять с риском инфекционных осложнений, иммунологических побочных эффектов, а также перегрузки организма пациента железом.
Накопление в организме избыточного железа представляет собой серьезную клиническую проблему, которая, если ее не решать, может привести к повреждению органов. Повторные переливания эритроцитов, содержащих железо в составе гемоглобина, приводят к депонированию избытка железа в клетках ретикулоэндотелиальной системы, прежде всего в печени, селезенке, железах внутренней секреции и сердце, а также в небольшом количестве в тканях мозга или скелетных мышцах. Поэтому главными осложнениями перегрузки железом являются заболевания сердца, печени и эндокринные нарушения. С целью профилактики перегрузки организма железом используется лабораторный контроль за его запасами (ферритин сыворотки), а также препараты, которые хелатируют, или связывают железо, способствуют его выводу из организма.
В настоящее время имеются два препарата для борьбы с перенасыщением железом у больных, зависящих от переливания крови - дефероксамин и деферасирокс.
Препарат дефероксамин (Десферал) задерживает токсическое действие накопления избыточного количества железа в организме. Он назначается в дополнение к переливанию крови и вводится посредством инъекции обычно 3-7 раз в неделю. Некоторые больные получают подкожные инъекции препарата 2 раза в день. Препарат деферасирокс (Эксиджад), хелатор, принимается перорально. Лечение этими препаратами следует начинать пациентам, получившим 20-30 единиц донорских эритроцитов, которым предстоит постоянная трансфузионная терапия, а также пациентам с уровнем ферритина сыворотки крови, постоянно превышающим 1000 мкг/л.
Потенциально излечивающие терапевтические методы
Для контроля над симптомами болезни или излечения МДС у молодых пациентов МДС высокого риска применяют интенсивную химиотерапию, чтобы максимально уничтожить клон патологических клеток и достигнуть длительной ремиссии.
Пациентам моложе 55 лет с МДС высокого или промежуточного 2 риска по шкале IPSS , не имеющим возможности трансплантации стволовых клеток, может подойти химиотерапия аналогичная той, что применяется для лечения ОМЛ. Данный метод лечения имеет значительные побочные эффекты, такие как выпадение волос, появление стоматита ротовой полости, тошнота, рвота, появление жидкого стула. Кроме этих побочных явлений, химиотерапия оказывает неблагоприятное воздействие на здоровые клетки наряду с клетками, подвергшимися диспластическим воздействиям, что требует длительного пребывания в условиях гематологического отделения. В это время пациенту производятся переливания эритроцитарной и тромбоцитарной массы, назначаются антибактериальные препараты для борьбы с инфекцией. Если индукционная химиотерапия обеспечивает адекватный контроль над патологическими клетками (состояние ремиссии), то восстановление нормальных клеток крови должно начаться в течение нескольких недель. К сожалению, вероятность контроля МДС с помощью индукционной химиотерапии составляет около 30%. Даже в случаях успешного лечения болезнь может возвращаться - рецидивировать.
1. Единственным известным методом лечения, способным излечить МДС, является трансплантация аллогенных (донорских) гемопоэтических стволовых клеток. Следует иметь в виду, что это сложная процедура, связанная с риском ранних и поздних осложнений. Исход лечения зависит от степени совместимости (HLA -совместимости) донора и пациента (реципиента), а также от доступности подходящих донорских клеток (наличие совместимых кровных братьев и/или сестер, доступность банка доноров). Таким образом, есть строгие показания и противопоказания для данного вида лечения: оно подходит для тех случаев, когда пациенты в состоянии перенести трансплантацию стволовых клеток и имеют подходящего донора. Недавно предложенные методы трансплантации с режимами кондиционирования пониженной интенсивности имели определенный успех у пациентов с МДС старше 55 лет. Исследования в этой области продолжаются.
2. Участие иммунных механизмов в развитии патологии костного мозга при МДС стало причиной разработки методов лечения с применением иммуносупрессоров. Из этой группы препаратов в лечении МДС используются антитимоцитарный глобулин (АТГ) и антилимфоцитарный глобулин (АЛГ) и циклоспорин А. Лечение АЛГ/АТГ более эффективно у пациентов молодого возраста с наличием антигена HLA - DR 15, получавших трансфузии эритроцитов в течение непродолжительного времени. Такое лечение позволяет добиться независимости от переливаний эритроцитов у 33% пациентов; у 56% пациентов с тяжелой тромбоцитопенией наблюдалось значительное повышение уровня тромбоцитов, а у 44% пациентов с нейтропенией уровень нейтрофилов повысился более 1х10 9 /л. Циклоспорин А оказался наиболее эффективным у пациентов, имеющих менее 5% бластных клеток в костном мозге, нормальный кариотип, гипоклеточный костный мозг и скопления лимфоидных клеток в трепанобиоптате.
3. Изучение механизмов развития МДС, предпринятое в последние годы показало, что для данной патологии характерно гиперметилирование промоторной области некоторых генов-онкосупрессоров, что приводит к «молчанию» этих генов и пролиферации опухолевых клеток и трансформации в ОМЛ. На основе этих знаний были разработаны так называемые гипометилирующие агенты, которые содействуют гипометилированию ДНК, вызывая экспрессию ранее «выключенных» генов.
В мае 2004 года Управление США по контролю за продуктами питания и лекарственными препаратами (Food and Drug Administranion , FDA ) выдало разрешение на применение инъекционного препарата азацитидин (Вайдаза) для лечения всех типов МДС. В РФ препарат был одобрен к применению в 2010 году для лечения МДС, ОМЛ И ХММЛ. Результаты исследования показали, что азацитидин достоверно продлевает жизнь пациентам с миелодиспластическим синдромом (МДС) промежуточного и высокого риска, а также с острым миелоидным лейкозом 20-30% бластов (ранее относился к МДС высокого риска), которым не показана трансплантация стволовых клеток/интенсивная химиотерапия.
Согласно принятым в России протоколам, лечение пациентов МДС промежуточного-2/высокого риска и ОМЛ, которые не подходят для интенсивной химиотерапии, осуществляется низкими дозами цитарабина и/или с помощью поддерживающей терапии. Такое лечение позволяет облегчить симптомы болезни, улучшить качество жизни пациентов, но не имеет других существенных преимуществ в сравнении с естественным течением болезни. В то же время продолжительность жизни пациентов с МДС высокого риска, получающих азацитидин, увеличивается в 3 раза по сравнению с принятым лечением. При этом различия группы азацитидина с группами поддерживающей терапии и низких доз цитарабина статистически достоверны (р=0,045), независимо от возраста или кариотипа (анализ данных исследования III фазы AZA -001)
Азацитидин увеличивает количество больных МДС, не нуждающихся в гемотрансфузиях, в 4 раза. Кроме того, азацитидин показан в качестве временной терапии у пациентов, ожидающих донора для трансплантации (рекомендации по терапии МДС, NCCN , 2010).
К нежелательным явлениям 3-4 степени, развивающимся на фоне лечения азацитидином, относятся гематологические (71.4%), включая тромбоцитопению (85%), нейтропению (91%) и анемию (57%). Фебрильная нейтропения встречалась у 8.0% пациентов, крайне редко (<2%) регистрировались нейтропенический сепсис, пневмония, тромбоцитопения и геморрагические нежелательные явления.
Азацитидин вводится подкожно 75 мг/м 2 1 р/день 7 дней через 21 день (цикл), не менее 6 циклов. Он имеет благоприятный профиль безопасности и может применяться амбулаторно.
В мае 2006 года комитет FDA одобрил применение для лечения всех подтипов МДС еще одного гипометилирующего препарата – децитабина (Дакогена). К применению для лечения МДС в РФ препарат был одобрен в 2006 году.
В открытом рандомизированном исследовании III фазы с участием 170 пациентов, сравнивавших децитабин с поддерживающей терапией, частота достижения ремиссии составила 17%, гематологическое улучшение было отмечено еще у 13% пациентов. Децитабина уменьшает риск трансформации в лейкоз и у пациентов, которые достигают ответа, увеличивает выживаемость. Вероятность трансформации в острый миелоидный лейкоз или смерти была в 1,68 раза выше в группе поддерживающей терапии по сравнению с группой с применением децитабина.
При проведении терапии децитабином наиболее частыми были следующие побочные эффекты: нейтропения-90%, тромбоцитопения-89%, анемия-82%, лихорадка -53%, тошнота-42%.
Децитабин вводится внутривенно (15 мг/м2 путем 3-часовой внутривенной инфузии каждые 8 часов в течение 3 последовательных дней каждые 6 недель на протяжении 10 циклов).
Терапия как азацитидином, так и децитабином должна проходить под контролем врача-гематолога, имеющего опыт лечения больных МДС и ОМЛ.
4. В декабре 2005 года FDA США одобрило применение иммуномодулирующего препарата леналидомид для лечения пациентов из группы низкого или промежуточного -1 риска с МДС, в том числе с del (5 q ). Препарат применяется перорально в капсулах, обладает иммуномодулирующим, антиангиогенным и противоопухолевым эффектом. Вместе с этим у него отсутствует нейротоксичность, свойственная другим препаратам из данной химической группы. Частота достижения ремиссии на фоне лечения леналидомидом составила 83% у пациентов с клональной интерстициальной делецией хромосомы 5 q 31.1, в то время как у пациентов с нормальным кариотипом частота достижения ремиссии составила 57%, а у пациентов с другими аномалиями кариотипа – 12%. В исследовании II фазы с участием 146 пациентов с МДС низкого или промежуточного 1 риска с del (5 q 31), нуждающихся в постоянной трансфузионной терапии, 64% пациентов перестали нуждаться в трансфузиях. Частота достижения трансфузионной независимости была выше среди пациентов с изолированной del (5 q ) (69%), чем у остальных пациентов (49%; Р=0,003).
В феврале 2012 файл по леналидомиду был принят в Европейском Медицинском Агентстве для регистрации этого показания – «для лечения пациентов с МДС низкого/промежуточного-1 риска, вариант трансфузионно зависимой анемии с del (5 q ) с/без других цитогенетических аномалий» .
Таким образом, миелодиспластические синдромы (МДС) представляют собой гетерогенную группу заболеваний костного мозга, для которых характерен неэффективный гемопоэз и различная степень риска трансформации в острый лейкоз. Диагностика МДС может представлять трудность, ввиду наличия у них общих черт с другими гематологическими заболеваниями, включая ОМЛ, апластическую анемию и наследственную сидеробластную анемию. Исследования, направленные на раскрытие механизмов болезни, которые ведут к возникновению МДС, помогают нам лучше понять МДС. Не менее важным является то, что лучшее понимание механизмов болезни ведет к созданию новых препаратов для лечения различных подтипов МДС у больных, относящихся к различным группам риска.
Лишь недавно лечение МДС вышло за рамки поддерживающей терапии, проводившейся с целью облегчения симптомов. Единственным потенциально излечивающим методом терапии МДС является аллогенная трансплантация гемопоэтических клеток, которая, однако, возможна не во всех случаях.
В последние годы на основе изучения патогенеза данной патологии разрабатывается большое количество лекарственных препаратов, часть из которых найдет свое место в лечении МДС. В качестве примеров можно привести ингибитор ангиогенеза бевацизумаб (Авастин), ингибитор цитокинов инфликсимаб (Ремикейд), ингибиторы деацетилазы, гистонов -вальпроевая кислота и вориностат, многие другие. Научные данные позволяют полагать, что комбинированная терапия препаратами с различными механизмами действия приведет к искомой эффективности лечения.
Но, какая бы терапевтическая стратегия в конечном итоге не выбиралась, в ней должны учитываться решение пациента.
Существует целая группа заболеваний, которая характеризуется снижением концентрации всех форменных элементов крови. Данные патологии объединены в миелодиспластический синдром (МДС). Эта проблема обусловлена снижением продукции клеток костным мозгом. К заболеванию предрасположены люди пожилого возраста, а также пациенты, проходящие химиотерапевтическое лечение. Недуг опасен тем, что может трансформироваться в лейкоз – рак крови.
Классификация синдрома
Принято разделять первичную и вторичную патологии. Последняя отличается худшим прогнозом и большей устойчивостью к лечению. Это связано с тем, что дисплазия в таких случаях возникает в ответ на применение цитостатиков и других химиотерапевтических агентов, имеющих среди побочных эффектов угнетение функции костного мозга. Первичный синдром лучше поддается терапии и возникает идиопатически.
Принята классификация, которая делит миелодисплазию на несколько типов:
- Рефрактерная анемия представляет собой явление, сопровождающееся снижением количества красных клеток крови, которое имеет устойчивый характер. При этом бласты в анализе отсутствуют либо определяются в небольшом количестве. Подобное состояние сохраняется до полугода.
- Рефрактерная анемия с кольцевыми сидеробластами также отличается устойчивостью. При данной проблеме в анализах крови определяются клетки с аномальным расположением гранул железа. В костном мозге выявляют изменение эритроидного отростка.
- Малокровие с многолинейной дисплазией сопровождается только увеличением содержания моноцитов – специфических клеток иммунной системы. Количество бластов в анализах крови незначительное, растущие структуры появляются и в костном мозге. При этом дисплазия отмечается только в одной миелоидной линии.
- Рефрактерная анемия с избытком бластов-1 характеризуется наличием в анализах палочек Ауэра – своеобразных белковых включений в моноцитах. Они имеют красный цвет при специфическом окрашивании. Количество бластов превышает 5%. В костном мозге отмечается дисплазия нескольких клеточных линий. Тельца Ауэра при этом обнаруживаются только в образцах крови.
- При устойчивом малокровии с избытком бластов-2 отмечается цитопения. Количество растущих несозревших клеток достигает 19%. При данной проблеме палочки Ауэра выявляются уже в костном мозге.
- Миелодиспластический синдром, ассоциированный с патологией 5 хромосомы, характеризуется тромбоцитозом на фоне анемии. Отмечается также наличие миелобластных клеток, количество которых превышает 5%. Специфическая черта – перестройка генетического материала, сопровождающаяся частичной его утратой.
- Неклассифицируемый миелопатический синдром не отличается специфическими признаками. Выявляется лишь дисплазия гранулоцитарного ростка.
Симптомы патологии
Клиническая картина заболевания зачастую нехарактерна. Для нарушения гемопоэза характерно долгое латентное течение. Панцитопения, или снижение концентрации клеток крови, во многих случаях является случайной находкой при прохождении пациентом диспансеризации. Проявления МДС зависят от степени выраженности нарушений синтеза клеток костным мозгом. Классические симптомы болезни:
- Общая слабость и плохая переносимость физических нагрузок.
- Появление одышки сначала во время активности, а позднее и в покое. Это обусловлено снижением концентрации эритроцитов, одна из функций которых заключается в переносе кислорода к тканям.
- Развитие головокружения и обморочные состояния. Обусловлены как общей слабостью и истощенностью организма, так и дыхательной недостаточностью.
- На более поздних стадиях у пациентов выявляется повышенный риск кровотечений. Формируются петехии, а также гематомы на месте незначительных травм.
- Когда происходит развитие панцитопении, снижается и иммунная защита. Это сопровождается постоянными вирусными заболеваниями, возникновением инфекционных поражений ротовой полости, гортани и легких. В самых тяжелых случаях процесс приобретает генерализованный характер и развивается сепсис.
Причины возникновения
Идиопатический тип недуга, то есть первичное заболевание, формируется в 85% случаев. Миелодиспластический синдром провоцируется следующими факторами:
- Воздействие радиации, а также контакт с канцерогенными веществами – растворителями, пестицидами и т. д. Эти соединения обладают свойством угнетать работу костного мозга.
- Наличие врожденных наследственных заболеваний, способных пагубно влиять на гемопоэз.
- Прием лекарственных средств, угнетающих работу иммунной системы. К данной категории относятся вещества, применяемые в трансплантологии и лечении ревматоидных проблем.
- Пожилой возраст также является фактором, увеличивающим вероятность развития миелодиспластического синдрома. Это связано с накоплением в течение жизни генетических ошибок, способных привести к нарушению работы костного мозга.
К причинам, вызывающим вторичный МДС, относят химиотерапевтическое лечение «Циклоспорином», «Доксорубицином» и другими препаратами, а также применение ионизирующей радиации при борьбе с новообразованиями. Угнетение миелопоэза – распространенное и опасное осложнение в онкологии.
Диагностика
Обследование начинают со сбора анамнеза. При наличии у пациента жалоб на недомогание и общую слабость потребуется проведение анализов крови. Выявление в тестах снижения концентрации эритроцитов, а также панцитопении указывает на диагноз, связанный с нарушением гемопоэза. Лабораторные исследования играют ключевую роль в подтверждении миелодиспластических процессов. Они позволяют выявить наличие бластных, то есть растущих клеток, которые и указывают на формирование проблемы. Обследование включает и физикальный осмотр, в процессе которого обнаруживаются бледность слизистых оболочек и петехии на коже.
Применяются и визуальные методы, такие как ультразвук, который позволяет сделать фото внутренних органов. В тяжелых случаях на УЗИ обнаруживают увеличение размеров печени и селезенки.

Ключевым исследованием в диагностике лейкоза и миелодиспластического синдрома является биопсия костного мозга. Это довольно болезненная процедура, которая производится при помощи специальных игл. Полученный образец подвергается морфологическому анализу. В микропрепаратах обнаруживают бласты, тельца Ауэра, изменение соотношения клеток эритроидного ряда и другие отклонения. На основании результатов данного теста болезнь классифицируют.
При этом важно учитывать, что зачастую даже стандартное гистологическое исследование не дает точного результата. Это связано с необходимостью типирования находящихся в образце клеток. Подобная дифференциация имеет важное прогностическое значение, а также влияет на тактику лечения недуга. С этой целью требуется использование наиболее современных методов, например, проточной цитометрии. Данная техника активно применяется в развитых странах для диагностики онкологических процессов в костном мозге, лимфатической системе и крови.
Иммунофенотипирование позволяет различать клоны клеток. Причем анализ способен дифференцировать как бласты, так и зрелые структуры. Специфического маркера, указывающего на возникновение миелодиспластического синдрома, на сегодняшний день нет. Однако существуют комбинации параметров, используемых при проточной цитометрии, которые позволяют с высокой точностью определить не только наличие патологического процесса, но и выявить его тип. Такой анализ полезен и тем, что обладает высокой чувствительностью. Он помогает поставить диагноз в наиболее сложных случаях, например, у пациентов, страдающих от миелопатии, лишенной специфических маркеров или лабораторных признаков.
Методы лечения
Клинические рекомендации при миелодиспластическом синдроме зависят от типа заболевания, его причины и состояния пациента на момент постановки диагноза. Тактика борьбы с недугом определяется врачом. Основной задачей является облегчение состояния человека. Поскольку классическим проявлением проблемы считается угнетение работы костного мозга, применяются средства для его стимуляции. Например, «Эритропоэтин» относится к препаратам, усиливающим кроветворение. Это способствует устранению анемии и связанных с ней гипоксических явлений. В числе рекомендаций при борьбе с МДС и такой медикамент, как «Ревлимид», который является эффективным иммуностимулятором. Он провоцирует активное производство иммунных клеток, что улучшает дальнейший прогноз заболевания.
Лечение миелодиспластического синдрома предполагает также борьбу с секундарной микрофлорой. Поскольку при панцитопении защитные силы организма ослабевают, оправдано использование антибиотиков широкого спектра действия. Это позволяет профилактировать сепсис.
Чтобы повысить содержание форменных элементов крови, применяется заместительная терапия. Она значительно улучшает лабораторные показатели и состояние пациента за короткий срок. Уменьшаются проявления малокровия или панцитопении. Переливание крови оправдано в наиболее тяжелых случаях, когда добиться выраженного эффекта при применении стимуляторов гемопоэза не удается.
На сегодняшний день методом выбора в борьбе с МДС является трансплантация стволовых клеток. Она позволяет восстановить нормальную работу костного мозга и значительно улучшает состояние пациентов. Основную проблему при этом составляет поиск доноров.
Прогноз при миелодиспластическом синдроме
Исход недуга зависит от причины его возникновения и состояния больного. Проблема опасна тем, что может трансформироваться в онкологический процесс – острый лейкоз, излечение которого не всегда возможно. Прогноз при миелодиспластическом синдроме, как правило, осторожный. Идиопатический процесс гораздо лучше отвечает на терапию, чем вторичная проблема. Чем раньше МДС обнаружен, тем выше шанс на выздоровление.
К возникновению лейкоза в острой форме, диспластическим отклонениям в костном мозге может привести миелодиспластический синдром. Патология чаще поражает лиц мужского пола после 60 лет, а у детей диагностируется лишь в 5% случаев.
Что такое миелодиспластический синдром?
Миелодиспластический синдром или МДС – группа заболеваний онкологического типа, которые характеризуются нарушением воспроизведения нескольких или одного вида клеток крови. При патологии стволовые клетки не могут правильно развиваться и делиться, они превращаются в онкологические структуры или формируют бласт незрелых клеток. Нормально функционировать в человеческом организме способны только зрелые клетки, количество которых при МДС уменьшается. Такое состояние в медицине называют .
По типу кровяных клеток, цитопению подразделяют на 3 вида:
- – при недостатке гемоглобина в крови.
- Нейтропения – при дефиците лейкоцитов в организме.
- Тромбоцитопения – при нехватке тромбоцитов.
Чем опасен миелодиспластический синдром?
Из-за недостаточного количества клеток крови у пациентов развивается анемия, сердечная недостаточность, увеличивается риск заражения инфекционными возбудителями. МСД, связанный с анемией, становится причиной быстрой утомляемости и головокружений у больного. Этот вид патологии считается наиболее легким, среди всех имеющихся типов.
Недостаток лейкоцитов в крови сказывается на работе иммунной системы – человек становится уязвимым перед инфекционными заболеваниями. Нарушение функционирования защитных сил организма приводит к различным осложнениям – от стоматита до пневмонии.
При тромбоцитопении нарушается сворачиваемость крови, в результате чего любые травмы и порезы могут привести к обильной кровопотере. Серьезные травмы при патологии становятся причиной летального исхода.
Миелодиспластический синдром и онкология
Миелодиспластический синдром и рак крови взаимосвязаны. МДС в запущенных стадиях может привести к онкологии. Но синдром не обязательно перерастает в рак. При легких типах заболевания, например, при рефракторной анемии, не возникает перерождения незрелых клеток в злокачественные.
Вторичные формы МСД встречаются среди больных раком. Причиной этому служат препараты, применяемые во время химиотерапии. В данном случае заболевание протекает в острой форме и трудно поддается медикаментозной терапии.
Как часто встречается МДС?
По причинам возникновения МДС подразделяют на первичный и вторичный тип. Идиопатический тип патологии диагностируется в большинстве случаев (80-90%) у пациентов старше 60 лет. Вторичный тип встречается в 10% случаев и может быть диагностирован в любом возрасте.
В последнее время заболевание все чаще встречается у пациентов трудоспособного возраста. Считается, что причиной «омоложения» МДС является неблагоприятная экологическая обстановка.
Причины и группы риска
Точные причины проблемы не изучены. К факторам, способствующим развитию заболевания, относят:
- наследственные генные мутации – синдром Дауна, нейрофиброматоз;
- вдыхание вредных веществ – бензола, алкила;
- прием медикаментов, угнетающих работу иммунной системы;
- ионизирующее облучение.
В группе риска по заболеванию находятся онкобольные и лица мужского пола, старше 60 лет.
Классификации и виды
Существует несколько классификаций заболевания согласно ВОЗ:
Рефракторная анемия:
В крови обнаруживается дефицит эритроцитов, при этом количество лейкоцитов и тромбоцитов остается в норме.
Рефракторная анемия с незрелыми ядросодержащими клетками костного мозга (с кольцевыми сидеробластами):
В анализах обнаруживается недостаток эритроцитов, с повышенным содержанием железа в клетках. Количество тромбоцитов и лейкоцитов в норме.
Рефракторная анемия с избыточным количеством бластов, находящихся на этапе трансформации:
Низкое количество эритроцитов к крови. Отмечается отклонение числа тромбоцитов и лейкоцитов от нормальных значений. В косном мозге наблюдается от 5-19% бластов.
Рефракторная цитопения с мультилинейной дисплазией:
Происходит снижение минимум двух ростков крови. В костном мозге выявляется до 5% бластов, в периферической крови – до 1%. Заболевание способно трансформироваться в лейкемию.
МДС с изолированным хромосомным отклонением:
В крови пациента недостаточно эритроцитов. В костном мозге определяется до 5% бластов, в анализах крови – до 1%. В хромосомах обнаруживаются специфические изменения.
Неклассифицируемый МДС:
В крови занижено количество тромбоцитов, эритроцитов или лейкоцитов. Количество бластов в крови и костном мозге в пределах нормы.
Первые признаки
Первые симптомы патологии – общая слабость и одышка. Иногда симптомы МДС никак не проявляют себя на начальных стадиях. Синдром выявляется случайно во время исследования крови в лаборатории. Первые признаки заболевания схожи по симптомам с патологиями печени и аутоиммунными нарушениями. К ним относится:
- бледность кожных покровов;
- возникновение синяков даже при незначительных травмах;
- образование точечных подкожных кровоизлияний;
- частые ОРВИ.
Зрелые симптомы
По мере прогрессирования болезни проявляются и другие признаки:
- быстрая утомляемость даже при легких физических нагрузках;
- ухудшение аппетита;
- потеря веса;
- подъем температуры до 40 градусов;
- трудности с дыханием при отсутствии астматических проявлений;
- обширные подкожные кровоподтеки;
- снижение гемоглобина в крови;
- болевые ощущения в костях и суставах;
- гепатомегалия.
Что входит в диагностику?
Основные исследования для подтверждения заболевания – анализ крови на биохимию, цитогенетический и иммуногистохимический анализы клеток костного мозга. Кроме этого, при подозрении на МДС пациентам назначают следующие виды обследований:
Инструментальные методы диагностики позволяют оценить состояние других органов и систем. Перед постановкой диагноза в обязательном порядке проводится дифференциация, для того, чтобы исключить:
- острый лейкоз;
- отравление организма ядовитыми веществами;
- миелодепрессивный синдром;
- проблемы с белковым обменом;
- патологии печени.
Как лечат сегодня?
Самый эффективный метод в борьбе с патологией – трансплантация костного мозга. Способ терапии имеет множество недостатков: высокую стоимость, вероятность отторжения трансплантата, необходимость дополнительной подготовки пациента к операции. Для осуществления процедуры трудно найти подходящего донора.
Перед трансплантацией стволовых клеток пациент должен пройти курс химиотерапии, который не всегда дает положительные результаты. Среди побочных эффектов процедуры отмечают: повреждение внутренних органов (особенно печени), . Для проведения химиотерапии чаще всего используется “Цитарабин” или “Децитабин”. Лекарства назначаются в высокой или низкой дозировке. Все зависит от возраста пациента, степени тяжести заболевания и общего состояния здоровья. Пожилые люди тяжело переносят данный вид лечения, поэтому химиотерапию им назначают только в крайних случаях.
Современный метод борьбы с МДС – трансплантация стволовых клеток. Побочные эффекты от процедуры такие же, как и при пересадке костного мозга. Данный способ позволяет предотвратить развитие острой лейкемии.
Немалую роль в борьбе с МДС играет переливание крови или сопроводительная терапия. Благодаря устраняется симптоматическая картина заболевания. Кровь вводится в организм больного в виде тромбоконцентрата или эритроцитарной массы. Сопроводительная терапия проводится в течение короткого промежутка времени, поскольку избыток железа в организме может дать побочные эффекты. Переливание крови нередко совмещают с медикаментозным лечением. К препаратам, стимулирующим выработку клеток крови, относят:
- “Нейпоген”;
- “Лейкин”;
- “Эритропоэтин”.
Также, при МДС назначаются лекарства для коррекции иммунитета, например, “Леналидомид”. С целью предупреждения лейкемии пациенту внутривенно вводят “Азацитидин”.
Прогноз и сколько живут такие пациенты?
Прогноз жизни при МДС, составленный ВОЗ, основывается на трех основных факторах:
- Кариотипе человека (по критерию ставится от 0-2 баллов).
- Разновидности патологии (по критерию ставится от 0-3 баллов).
- Необходимости в гемотрансфузии (от 0 -1 балла).
Баллы по трем критериям суммируются, и на основе показателя рассчитывается прогноз жизни больного МДС.
Этот прогноз является приблизительным. Выживаемость пациента также во многом зависит от состояния здоровья и морального настроя.
Пациенты, которым был поставлен диагноз миелодиспластический синдром, задаются вопросом – может ли заболевание перерасти в рак. Однозначно ответить на этот вопрос невозможно, все зависит от типа проблемы и отношения человека к своему здоровью. Если пациент при возникновении первых признаков патологии обратился к специалисту, то с большей долей вероятности незрелые клетки не превратятся в злокачественные.