Технологический процесс обработки изделий, аппаратов и оборудования медицинского назначения регламентирован требованиями главы II СанПиН 2.1.3.2630-10 "Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность" и включает последовательное проведение этапов дезинфекции, ПСО и стерилизации.
Обеззараживание наркозно-дыхательных аппаратов, в соответствии с требованиями п. 2.7 главы II и п.6.6 главы III CанПиН 2.1.3.2630-10 проводят с учетом рекомендаций, изложенных в руководстве по эксплуатации аппарата конкретной модели. А съемные детали аппаратов дезинфицируют как изделия медицинского назначения с учетом особенностей воздействия химических и физических агентов на материалы изделия, методами и способами утвержденными МУ МЗ РФ от 30.12.1998г. № 287-113 "Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения"
В отношении обработки дыхательных контуров, требованиями СанПиН 2.1.3.2630-10 рекомендуется использование контуров однократного применения в течение не более 72 часов для каждого пациента, если иное не предусмотрено производителем.
В соответствии с требованиями п.2.19 и п.2.31 главы II CанПиН 2.1.3.2630-10, стерилизация изделий медицинского назначения (в том числе съемных деталей аппарата) многократного применения, выполненных из термостойких полимерных материалов осуществляется водяным насыщенным паром в паровых стерилизаторах (автоклавах), из термолабильных материалов - химическим способом. Изделия медицинского назначения, не контактирующие с раневой поверхностью, кровью (в организме пациента или вводимой в него) и/или инъекционными препаратами и не соприкасающиеся со слизистой оболочкой в процессе эксплуатации, согласно п.2.15 главы II CанПиН 2.1.3.2630-10, стерилизации не подлежат. Исключение представляют случаи, указанные производителем в эксплуатационной документации изделия.
Условия хранения (упаковка и сроки) зависят от применяемого в организации метода стерилизации. Допускается хранение не более 3 суток в стерильной стерилизационной коробке, выложенной стерильной простыней. Заполнение резервуаров увлажнителей стерильной дистиллированной водой, установка фильтров, съемных деталей аппарата осуществляют при подготовке наркозно-дыхательной аппаратуры к использованию, в соответствии с инструкцией по применению (обращая внимание на количество указанных изготовителем изделий циклов обработки).
Заполнение резервуаров увлажнителей стерильной дистиллированной водой, установка фильтров, съемных деталей аппарата осуществляют при подготовке наркозно-дыхательной аппаратуры к использованию, в соответствии с инструкцией по применению, обращая внимание на количество указанных изготовителем циклов обработки изделия.
Небулайзеры PARI LC SPRINT® и аксессуары к ним разработаны для многократного использования как в клинике,
так и в домашних условиях.
Их необходимо очищать, дезинфицировать или стерилизовать после каждого использования. Для различных условий применения существуют разные рекомендации по очистке, дезинфекции и стерилизации.
ПОЧЕМУ НЕОБХОДИМО ОЧИЩАТЬ НЕБУЛАЙЗЕР?
Недостаточная или неэффективная дезинфекция способствует росту микроорганизмов и тем самым увеличивает опасность инфекции. Чтобы предотвратить риск для здоровья, необходимо строго следовать правилам гигиены.
Остатки медикамента не должны оставаться в резервуаре небулайзера
Попадание выдыхаемого пациентом воздуха в верхнюю часть камеры
небулайзера приводит к распространению инфекции
Попадание мокроты при кашле во время ингаляции в верхнюю часть
камеры небулайзера приводит к загрязнению
Необходима техническая очистка сопла
Спектр действия средства для дезинфекции и стерилизации
Подготовка к очистке
Отсоедините трубку-воздуховод от распылителя.
Разберите распылитель на составные части.
Осторожно выньте клапан выдоха на мундштуке из прорези. После этого клапан должен остаться висеть на мундштуке.
В домашних условиях (для одного пациента)
|
Для очистки всех отдельных деталей (кроме трубки-воздуховода) их требуется тщательно промыть в течение примерно 5 минут теплой водопроводной водой с моющим средством.
При наличии сильных загрязнений используется чистая щетка (эту щетку разрешается применять только для данной цели).
Тщательно промойте все детали под проточной теплой водой. В посудомоечной машине:
Небулайзер очищать отдельно от посуды, части небулайзера поместить в корзину для столовых приборов, выбрать программу при t 50°C или выше
|
|
В кипящей воде:
Положите отдельные детали распылителя в кипящую воду не менее чем на 5 минут.
Используйте чистую кастрюлю и свежую питьевую воду.
С помощью термо дезинфектора бутылок для младенцев (не в микроволновой печи):
Для эффективной дезинфекции используйте термо дезинфектор, время работы которого составляет не менее 6 минут. Необходимо соблюдать указания руководства по эксплуатации используемого при- бора для дезинфекции.
С помощью микроволнового дезинфицирующего устройства:
Микроволновые дезинфицирующие устройства обеспечивают эффективную дезинфекцию деталей изделия в бытовой микроволновой печи. Положите детали изделия в дезинфицирующее устройство на достаточном расстоянии друг от друга, чтобы водяной пар мог воздействовать на все поверхности.
Химическая дезинфекция:
Используя химическую подготовку, можно выполнить очистку и дезинфекцию вместе. Используйте для этого чистящее дезинфицирующее средство Bomix® plus.
Надлежащая очистка и дезинфекция возможна только в случае соблюдения указанного соотношения компонентов смеси, а также указанного времени воздействия, и если все отдельные детали в течение всего времени воздействия полностью покрыты раствором. Нельзя допускать наличия пустых про- странств и воздушных пузырей.
Подготовьте 2 % раствор Bomix® plus, смешав для этого 10 мл концентрата с 500 мл водопроводной воды.
Положите все детали в подготовленный раствор и оставьте их в нем на 5 минут.
Тщательно промойте все детали под проточной или кипяченой водой (остатки дезинфицирующего средства могут вызвать аллергические реакции или раздражение слизистых оболочек).
Для безопасной работы с химикатами необходимо учитывать информацию об использовании дезин- фицирующего средства и особенно соблюдать указания по безопасности
|
| СТЕРИЛИЗАЦИЯ
|
Не требуется
|
Использование в клинике (для многих пациентов)
- Если пациент не меняется: Выполняйте чистку распылителя и используемых аксессуаров после каждой ингаляции. Выполняйте дезинфекцию распылителя и используемых аксессуаров не менее одного раза в день.
- Если пациент меняется: Выполняйте чистку, дезинфекцию и стерилизацию распылителя и используемых аксессуаров перед каждой сменой пациента. Замените соединительный шланг, так как его невозможно подготовить для смены пациента. Распылитель разрешается стерилизовать до 300 раз или использовать не более 1 года. Запрещается подвергать распылитель и используемые аксессуары воздействию температуры выше 137 °C
НЕБУЛАЙЗЕР, МАСКИ ПЛАСТМАССОВЫЕ И СИЛИКОНОВЫЕ ДЛЯ ДЕТЕЙ И ВЗРОСЛЫХ, АКСЕССУАРЫ: СИСТЕМА PARI PEP S, TRACHEOSTOMA SET, ТРЕНАЖЕР PARI-O-PEP, PARI ФИЛЬТР-КЛАПАН
| ОЧИСТКА (после каждой ингаляции)
|
Машинная чистка
ОСНАЩЕНИЕ
Чистящая и дезинфицирующая машина согласно DIN EN ISO 15883
Чистящее средство
При необходимости нейтрализатор
ВЫПОЛНЕНИЕ
Разместите отдельные части таким образом, чтобы обеспечить их оптимальную чистку.
Выберите подходящую программу чистки и чистящее средство. Ручная чистка
ОСНАЩЕНИЕ
Чистящее средство,щетка
Теплая вода (около 50 °C);
ВЫПОЛНЕНИЕ
Положите все отдельные детали в чистящий раствор
Тщательно очистите все детали с помощью щетки
Тщательно промойте детали гигиенически чистой водой и положите их на сухую, чистую и не содержащую пыли поверхность для полной сушки
|
| ДЕЗИНФЕКЦИЯ (после каждой ингаляции)
|
Положите все отдельные детали в дезинфицирующий раствор (см. таблицы 1,2)
Дайте средству подействовать согласно инструкции по использовании дезинфицирующего средства.
Тщательно промойте детали гигиенически чистой водой и положите их на сухую, чистую и не содержащую пыли поверхность для полной сушки. Внимание!
Составные части изделия PARI не подходят для обработки дезинфицирующими средствами для медицинских инструментов на основе четвертичных аммониевых соединений. Четвертичные аммо- ниевые соединения могут накапливаться в пластмассовых деталях, что может привести к аллергическим реакциям у пациентов.
СТЕРИЛИЗАЦИЯ ПЛАСТМАССОВОЙ МАСКИ ПРОВОДИТСЯ ТОЛЬКО С ИСПОЛЬЗОВАНИЕМ СПЕЦИАЛЬНОГО СТАБИЛИЗАТОРА!
|
| СТЕРИЛИЗАЦИЯ (после каждой ингаляции)
|
ОСНАЩЕНИЕ
Паровой стерилизатор (предпочтительно со ступенчатым форвакуумом) согл. DIN EN 285 или DIN EN 13060 (тип B)
ВЫПОЛНЕНИЕ
Упакуйте все отдельные детали в систему со стерильным барьером согл. DIN EN 11607 (например, в бумажно-пленочную упаковку).
Максимальная температура стерилизации и время пребывания: 121 °C – 20 минут или 132 °C / 134 °C – 3 минуты
|
ВНИМАНИЕ!
Детали изделия разрешается подвергать воздействию микроволнового излучения только в дезинфицирующем устройстве для микроволновой печи. Нагрев в микроволновой печи без соответствующего дезинфицирующего устройства ведет к повреждению деталей. Не используйте функцию гриля, это ведет к повреждению деталей. Хранение небулайзеров и аксессуаров ПАРИ: в клинике стерильные небулайзеры, маски и аксессуары хранить в стерильном пакете – 3 суток, в биксе – до 7 суток.
Факт обсеменения
наркозных аппаратов и аппаратов ИВЛ
патогенной микрофлорой и возможность
перекрестного инфицирования больных
очевидны. Основное или сопутствующее
заболевание также способствует снижению
сопротивляемости организма. Доказано
отрицательное влияние продленной ИВЛ
на состояние слизистой оболочки
дыхательных путей и активность
мерцательного эпителия. Перекрестное
инфицирование и различные предрасполагающие
факторы увеличивают опасность
возникновения инфекционного процесса,
что определяет необходимость в очистке
и обеззараживании наркозно-дыхательной
аппаратуры.
При проведении
предварительной
очистки уменьшается количество патогенных
микроорганизмов, удаляются пирогенные
вещества, кусочки тканей и органические
остатки, которые могут быть токсичными
или препятствуют процессу дезинфекции.
Для предварительной очистки применяются
самые разнообразные моющие средства.
Широко используется 0,5% раствор перекиси
водорода, который является хорошим
окислителем, в сочетании с современными
синтетическими моющими средствами
(“Новость”, “Прогресс”, “Сульфанол“
и т.п.). Перечисленные средства обладают
высокой очищающей способностью, не
влияют на качество стекла, металла,
пластмасс, резины, легко смываются. При
температуре 50 о С
их активность значительно возрастает.
Промытые
под проточной водой детали аппаратов
замачивают в свежеприготовленном моющем
растворе в течение 15-20 мин. Затем
ватно-марлевыми тампонами моют отдельно
каждую деталь. Тампоны используют
однократно. Вымытые детали прополаскивают
в проточной и ополаскивают в дистиллированной
воде. Затем их протирают медицинским
спиртом. После этого все предметы должны
быть выложены на стерильную простыню
и тщательно высушены. Этим методом можно
снизить бактериальное обсеменение
более чем в тысячу раз.
При
последующей дезинфекции
учитывается,
из какого материала изготовлены детали
аппарата. Для термостойких материалов
самым простым методом дезинфекции
является кипячение в течение 30-35 мин в
дистиллированной воде с добавлением
гидрокарбоната натрия (20 г/л) или
стерилизация в автоклаве водяным паром
при 134 °С. Для нетермостойких материалов
лучше использовать химическую дезинфекцию
с применением одного из следующих
средств: 3% раствора перекиси водорода
(экспозиция 80 мин), 3% раствора
формальдегида (экспозиция 80 мин), или
одного из официнальных дезинфицирующих
растворов (“Аламинол”,
“Лизетол” и т. п.). При
обсеменении микобактериями туберкулеза
экспозицию увеличивают до 2 ч, а при
обсеменении возбудителем столбняка
или газовой гангрены - до 4 ч. Температура
дезинфицирующих растворов должна быть
не ниже 18 °С. После дезинфекции все
детали должны быть промыты стерильной
дистиллированной водой и высушены.
Хранить их следует в стерильных условиях.
Больше всего
обсеменению микроорганизмами подвержены
те части аппаратов, через которые
постоянно проходит выдыхаемая газовая
смесь. В результате микробы оседают на
всех присоединительных элементах,
коннекторах, гофрированных шлангах,
которые следует дезинфицировать по
описанной методике после каждого
использования.
Наружные поверхности
аппаратов подлежат ежедневной очистке
водой с моющими средствами. Особенно
тщательно следует чистить места около
кнопок, вентилей, кранов и ручек.
Окончательная обработка - протирка
салфетками из марли, смоченными 1%
раствором хлорамина. Если аппарат
использовался у инфицированного
больного, то после использования (или
ежедневно при продолжительном применении)
аппарат незамедлительно должен быть
вымыт 3% раствором перекиси водорода с
моющим средством, а затем тщательно
двукратно обработан 1% раствором хлорамина
с интервалом между протираниями
10-15 мин.
Дезинфекция
аппаратов в собранном виде осуществляется
парами формальдегида. После мытья
присоединительных элементов и шлангов
аппараты собирают и к тройнику пациента
присоединяют емкость с 10% раствором
формальдегида. Емкость ставят на
электронагревательный прибор и доводят
раствор до кипения; при этом пары
формальдегида непрерывно поступают в
аппарат. Экспозиция составляет 60 мин,
а при инфицировании микобактериями
туберкулеза - 90 мин. Нейтрализацию
паров формальдегида производят, подключая
к аппарату тем же способом емкость с
10% раствором аммиака (экспозиция -
30 мин). Затем аппарат продувают
воздухом в течение 30-50 мин. Минутный
объем вентиляции при обеззараживании
аппаратов в собранном виде должен быть
не менее 20 л/мин.
Очистка и
обеззараживание наркозно-дыхательной
аппаратуры требует достаточно много
времени и специально выделенного
персонала. Описанными методами можно
обойтись в хирургических стационарах
и отделениях интенсивной терапии малой
и средней мощности. В больших многопрофильных
хирургических клиниках все большее
применение находят специальные
дезинфицирующие камеры с большой
пропускной способностью. В качестве
примера можно привести дезинфицирующую
камеру «Aseptor 8800»
фирмы Dräger
(Германия). Это полностью автоматизированная
камера для дезинфекции крупных медицинских
аппаратов, включая наркозные аппараты
и респираторы. В качестве дезинфицирующего
средства служит формальдегид. В каждой
камере можно одновременно дезинфицировать
2-5 аппаратов в собранном виде. Одновременно
происходит обеззараживание не только
поверхности аппаратов, но и внутренних
просветов патрубков, шлангов, мешков и
т. д. Формальдегид нейтрализуется
аммиаком, а затем камера “продувается”
воздухом. Таким образом, всего за
40-120 мин один человек может провести
обеззараживание нескольких аппаратов.
Контроль за
эффективностью качества очистки
комплектующих изделий из органических
соединений осуществляют путем постановки
различных проб (бензидиновая,
фенолфталеиновая). Контроль обеззараживания
проводят путем смыва с внутренних
поверхностей масок, коннекторов, шлангов,
воздуховодов и т. п. с последующим
посевом на питательные среды на предмет
наличия патогенной флоры.
4.5. Инкубаторы и
открытые реанимационные системы (ОРС).
Поддержание оптимального микроклимата
- одно из основных требований при лечении
недоношенных детей и новорожденных
высокой степени риска. Известно, что
даже незначительный холодовой стресс
снижает выживаемость младенцев. Поэтому
необходимо поддерживать нейтральную
температуру окружаещей Среды, при
которой для сохранения нормальной
температуры тела требуется минимальный
уровень потребления кислорода.
Ориентировочные значения нейтральной
температуры окружающей среды представлены
в табл. 4.7.
|
Табл. 4.7. Значения нейтральной
температуры (С
о
)
|
|
|
Масса тела (г)
|
|
|
|
|
|
|
0-12
часов
|
|
|
|
|
|
|
|
|
|
|
|
26-96
часов
|
|
|
|
|
|
4-14
суток
|
|
|
|
|
Для поддержания
микроклимата при выхаживании новорожденных
используются инкубаторы и открытые
реанимационные системы (Рис. 4.20.)
Инкубатор - это
закрытая пластиковая камера в которой
контролируется и поддерживается
температура ребенка, температура и
влажность воздуха, концентрация кислорода
дыхательной смеси. Кроме того, в инкубаторе
имеются устройства и приспособления,
обеспечивающие проведение различных
лечебно-диагностических манипуляций
(взвешивание, изменение положения тела,
проведение фототерапи, рентгенографии
и др.).
В инкубаторе
температура тела обычно поддерживается
с помощью системы сервоконтроля, при
этом температурный датчик фиксируется
на коже ребенка. Идеальным местом
фиксации датчика является левое
подреберье. Не следут закреплять датчик
над ребрами или областью печени, так
как это может привести как к охлаждению,
так и к перегреванию ребенка.
Система сервоконтроля
обеспечивает высокоточное (
0.1 о
С) поддержание температуры, однако она
имеет и свои недостатки. Автоматический
контроль маскирует изменения температуры
тела при инфекционных заболеваниях, а
при отклеивании датчика возможно
перегревание ребенка.
Современные
инкубаторы позволяют достаточно точно
контролировать влажность воздуха, что
особенно важно при выхаживании
недоношенных детей. Так если для
новорожденных с массой тела более 1500 г
обычно достаточно поддерживать
относительную влажность на уровне
50-70%, то для детей с экстремально низкой
массой тела необходима влажность порядка
90-95% , что позволяет сократить объем
неощутимых потерь жидкости.
При отсутствии
нарушений герметичности (закрытые
окошки), в инкубаторе может автоматически
поддерживаться необходимая ребенку
концентрация кислорода в дыхательной
смеси. Все установленные параметры
микроклимата контролируются встроенной
мониторной системой.
Кроме
стационарных выпускаются и транспортные
модели инкубаторов. Это полностью
автономные устройства, имеющие собственные
источники энергообеспечения, газоснабжения,
аппараты для искусственной и вспомогательной
вентиляции легких, инфузионной терапии,
мониторные приборы и т.д. Транспортные
инкубаторы позволяют минимизироватьопасность
транспортировки новорожденных, особенно
при перевозке на большие расстояния и
в неблагоприятных климатических
условиях.
Открытые
реанимационные системы
(Рис. 4.21.) с источником лучистого тепла
имеют свои преимущества - облегчается
доступ к ребенку при проведении большого
количества лечебно-диагностических
манипуляций, уменьшаются колебания
температуры и влажности в процессе
лечения, как это бывает при частом
открывании окошек инкубатора. При
выхаживании новорожденных в ОРС нередко
используют пластиковый экран или
прозрачное пластиковое обдеяло, которые
позволяют существенно уменьшить
неощутимые потери жидкости у ребенка.
^
5. Очистка и дезинфекция наркозно-дыхательной аппаратуры (НДА)
5.1. Наркозно-дыхательные, анестезиологические аппараты и аппараты для искусственной вентиляции легких как новые, так и после каждого использования подвергают обработке (мойке и обеззараживанию). 5.2. В зависимости от конструктивных особенностей наркозно-дыхательные, анестезиологические аппараты и аппараты для искусственной вентиляции легких обрабатывают двумя способами: А) поблочно, Б) в собранном виде 5.3. При проведении анестезии и искусственной вентиляции легких (ИВЛ) обязательно использовать бактерильно-вирусные фильтры, во фтизиатрической практики использовать Хепа фильтры. 5.4. При использовании современной наркозно-дыхательной аппаратуры дезинфекция и стерилизация проводится согласно инструкции данной аппаратуры. 5.5. Обязательным условием надежности обеззараживания наркозно-дыхательного и анестезиологического оборудования и аппаратов для ИВЛ является мойка и дезинфекция отдельных элементов и блоков дыхательного контура и комплектующих аппарат деталей. 5.4 Очистке подвергают как новые аппараты с целью освобождения от пыли, связывающих, опудривающих веществ, так и аппараты после их использования с целью деконтаминации и удаления пирогенных веществ, кусочков тканей и других органических остатков. 5.5. Процесс мойки (поблочно) включает ряд последовательных этапов. 5.5.1. Подготовка - разборка узлов, снятие шлангов, присоединительных элементов, крышек клапанных коробок, отсоединение и опорожнение сборников конденсата и т.п. 5.5.2. Дезинфекция деталей проводится в 3% перекиси водорода 60 минут с полным погружением или другим дезинфектантом в соответствующей концентрации, согласно инструкции с обязательным заполнением полостей обрабатываемых деталей. 5.5.3. Последующую промывку осуществляют под струей проточной воды в возможно более короткие сроки после дезинфекции. Особенно это относится к присоединительным элементам и трубкам во избежание высыхания на них выделений, экссудата, крови и т.д. 5.5.4. Детали моют ватно-марлевыми тампонами в моющем растворе. Не следует для очистки и мытья использовать острые предметы, а также щетки или ерши, т.к. имеется опасность оставления в патрубках щетинок от щеток (ершей) и последующая их аспирация в дыхательные пути. Марлевые тампоны используют для мытья однократно. 5.5.5. Вымытые детали споласкивают под проточной водой не менее 3 минут. 5.5.6. Для определения остатков щелочных добавок ставят фенолфталеиновую пробу. При выявлении остатков щелочи (положительная проба) вся группа изделий, от которой отбирали изделия для контроля, подлежит повторной обработке до получения отрицательного результата. 5.5.8. Наркозно-дыхательная аппаратура стерилизуется путем погружения в 6% перекись водорода с экспозицией 360 минут или другим дезинфектантом, согласно инструкции. Все этапы предстерилизационной обработки и стерилизации проводится в операционном блоке. 5.5.9. После стерилизации элементы и детали просушивают стерильной простыней, затем перекладываются в другую стерильную простыню и хранятся в течение суток. 5.6. При использовании современной наркозно-дыхательной аппаратуры дезинфекция и стерилизация проводится согласно инструкции данной аппаратуры. ^
6. ОБРАБОТКА РУК ХИРУРГОВ
6.1. Обработку рук проводят все лица, участвующие в проведении оперативных вмешательств, родов, катетеризации магистральных сосудов. Обработка проводится в два этапа: I этап - мытье рук мылом и водой в течение двух минут, а затем высушивание стерильным полотенцем (салфеткой); II этап - обработка антисептиком кистей рук, запястий и предплечий, одним из антисептических препаратов, согласно инструкции к применению в ЛПУ на территории Узбекистана. 6.2. Стерильные перчатки надевают сразу после полного высыхания антисептика на коже рук. 6.3. Салфетки для мытья рук стерилизуются посредством автоклавирования, ногти обрабатываются специальной палочкой разового пользования. 6.4. Количество антисептика, необходимое для обработки, кратность обработки и её продолжительность определяются рекомендациями, изложенными в методических указаниях/инструкциях по применению конкретного средства.
Для хирургической обработки рук используют препараты, в том числе рецептуру «С-4».
6.6. Рецептуру «С-4» готовят из необходимого количества перекиси водорода и муравьиной кислоты, которые смешивают в стеклянном сосуде, последний помещают в холодную воду на 1-1,5 часа и периодически встряхивают.
^
Количество ингредиентов для приготовления рецептуры С-4
| |
Количество ингредиентов
| |
Количество рабочего раствора
|
30-33% перекись
|
Муравьиная кислота
|
Вода (л)
|
| |
водорода (мл)
|
100% (мл)
|
85% (мл)
| |
1
|
17,1
|
6,9
|
8,1
|
до 1
|
2
|
34,2
|
13,8
|
16,2
|
до 2
|
5
|
85,5
|
34,5
|
40,5
|
до 5
|
10
|
171,0
|
69,0
|
81,0
|
до 10
|
Раствор готовят и используют только в день операции.
6.7. Раствор хранится в стеклянной посуде не более суток в прохладном месте с герметичной пробкой. 6.8. Для обработки рук хирургов также применяют 0,5% спиртовый раствор препарата хлоргексидина биглюконата (препарат разводят в 70% спирте в соотношении 1:40). Обработка рук хлоргексидином проводится ватным тампоном в течение 5 минут. Антисептическое средство тампонами наносится на всю поверхность кистей предплечья до локтей и энергично растираются сначала правая, потом левая рука до локтей в течение не менее 2-х минут. При повторной обработке применяется новый стерильный тампон. 6.9. Для обработки рук используется также 1% р-р дегмина, или 0,1% р-р йодоперона-йодофора, обработка проводится 4 мин в тазу, а также другие препараты согласно инструкции. ^
7. ОБРАБОТКА ОПЕРАЦИОННОГО ПОЛЯ
7.1. При обработке операционного поля пациента перед хирургическим вмешательством и другими манипуляциями, связанными с нарушением целости кожных покровов и слизистых оболочек (пункции различных полостей, биопсии), предпочтение следует отдавать спиртосодержащим кожным антисептикам с красителем. 7.2. Не следует удалять волосы перед операцией, если только волосы возле или вокруг операционного поля не будут мешать её проведению. Если их необходимо удалять, то следует делать это непосредственно перед операцией, используя депиляторы (кремы, гели) или другие методы, не травмирующие кожные покровы. В экстренных случаях допускается стрижка и бритье волос. 7.3. Перед обработкой антисептиком кожу операционного поля следует тщательно вымыть и очистить ее и прилегающие области для устранения явных загрязнений. 7.4. Обработку операционного поля проводят путем протирания отдельными стерильными марлевыми салфетками, смоченными кожным антисептиком: этиловым спиртом 96 градусов, йодонатом, йодопироном, раствором хлоргексидина биглюконатом или другими препаратами используемыми для этих целей, в течение времени обеззараживания, рекомендованного методическими указаниями/инструкциями по применению конкретного средства. 7.5. Кожный антисептик при обработке неповрежденной кожи перед операцией следует наносить концентрическими кругами от центра к периферии, а при наличии гнойной раны – от периферии к центру стерильными тампонами. 7.6. Подготовленная область должна быть достаточно велика, чтобы в случае необходимости продолжить разрез или сделать новые разрезы для установки дренажей. 7.7. Рабочие растворы йодоната готовят ex tempore путем разбавления исходного раствора в 5 раз кипяченной или стерильной водой (соотношение 1:5). 7.8. Для изоляции кожи операционного поля применяют стерильные простыни, полотенца, салфетки. Может также использоваться специальная разрезаемая хирургическая пленка с антимикробным покрытием, через которую делают разрез кожи. ^
8. САНИТАРНО-ГИГИЕНИЧЕСКИЙ РЕЖИМ В ПАЛАТАХ ДЛЯ БОЛЬНЫХ С АНАЭРОБНОЙ ИНФЕКЦИЕЙ
8.1.
Источником инфекции являются больные газовой гангреной в любой форме: эмфизематозной, отечно-токсической, смешанной и газово-гнойной. 8.2.
Возбудители газовой гангрены относятся к роду патогенных клостридий - анаэробных спороносных бацилл. Как правило, ассоциация микробов может состоять из патогенных клостридий или из смеси патогенных и малопатогенных клостридий, а также из смеси клостридий с аэробными бактериями: стафилококком, кишечной палочкой, протеем. 8.3.
Основной путь передачи инфекций - контактный. Инфицирование может произойти при попадании газовой гангрены на поврежденные кожные покровы или слизистые оболочки с землей, грязным бельем, одежды, при использовании недостаточно простерилизованных инструментов, шприцев, игл, шовного и перевязочного материалов, а также через не обработанные руки медицинского персонала. 8.4. Для лечения больных газовой гангреной выделяют отдельные палаты. 8.5. Все помещения для больных с анаэробной инфекцией оборудуют настенными или потолочными бактерицидными лампами. 8.6.
При необходимости больной в приемном покое проходит полную или частичную санитарную обработку: принимает душ, стрижет ногти и т. д. 8.7. Перед поступлением и после выписки больного кровать, прикроватную тумбочку, подставку для подкладного судна (если таковая имеется) протирают ветошью обильно смоченной 6% раствором перекиси водорода с 0,5% моющего средства. Кровать заправляют постельными принадлежностями, прошедшую камерную дезинфекционную обработку по режиму для споровых форм бактерий. 8.8.
Посуду после использования освобождают от остатков пищи, замачивают в 2% растворе соды и кипятят в течение 20 минут, затем моют проточной водой и хранят в закрытом шкафу. 8.9.
Уборку палат производят не реже 2-х раз в день влажным способом с применением 6% раствора перекиси водорода с 0,5% моющего средства. 8.10. Уборочный материал (ведра, тазы, ветошь и т. д.) маркируют и используют строго по назначению. После использования их автоклавируют при 2 кгс/см2 (132°С) в течение 20 минут. 8.11. Хирург, процедурная сестра перед входом в перевязочную одевают маску, халат, бахилы. Во время операции или перевязки надевают клеенчатый фартук, который после каждой операции или перевязки протирают ветошью, обильно смоченной в 6% растворе перекиси водорода с 0,5% моющем средством. 8.13. Уборку операционно-перевязочного помещения проводят влажным способом не реже 2-х раз в день с применением 6% раствора перекиси водорода с 0,5% моющего средства. Во время текущей уборки необходимо использовать средства индивидуальной защиты. 8.14. Больному на время проведения сеанса гипербарической оксигенации выделяют индивидуальную подстилку типа небольшого матраца и подголовник. При невозможности соблюдения этого требования подстилку обшивают клеенкой или пленкой. После проведения сеанса меняют чехол, протирают подстилку ветошью с дезинфицирующим раствором. 8.15. Дезинфекцию внутренней поверхности барокамеры проводят после каждого сеанса оксигенации путем протирания стерильной ветошью, смоченной в 6% растворе перекиси водорода с 0,5% моющего средства. Затем насухо протирают стерильной пеленкой или простыней. 8.16.
Уборку барозала проводят влажным способом не реже 2-х раз в день с применением 6% раствора перекиси водорода с 0,5% моющего средства. При этом протирают все предметы и аппаратуру ветошью, смоченной в дезинфицирующем растворе, и вытирают насухо. В перерывах между сеансами гипербарической оксигенации включают бактерицидные облучатели. 8.17. После проведения операции или перевязки весь медицинский инструментарий погружают в 6% раствор перекиси водорода с 0,5% моющего средства на 60 минут или кипятят 20 минут от момента закипания. ^
9. САНИТАРНО-ГИГИЕНИЧЕСКИЙ РЕЖИМ ХИРУРГИЧЕСКИХ КАБИНЕТОВ ПОЛИКЛИНИК
9.1.Заведующий хирургическим кабинетом несет ответственность за соблюдение санитарно-гигиенического и противоэпидемического режима в кабинете. 9.2. Перед поступлением на работу медицинский персонал хирургических кабинетов проходит медицинский осмотр в соответствии действующего нормативного документа. 9.3. Медицинский персонал с воспалительными или гнойничковыми заболеваниями, недомоганием, лихорадкой, ОКЗ и др. острыми симптомами болезни не допускается к работе. 9.4. Весь работающий персонал хирургического кабинета должен состоять на диспансерном учете для своевременного выявления заболеваний носоглотки, кожи, кариозных зубов. 9.5.
Заместитель главного врача поликлиники 1 раз в год организовывает обследование персонала кабинетов хирургического профиля на маркеры вирусных гепатитов В, С. 9.6.
В хирургическом кабинете должны быть 2 перевязочные: Асептическая; Септическая. 9.7. Для каждого больного используются индивидуальные перевязочные/операционные наборы. 9.8. Персонал работает в специальной одежде, перед операцией (перевязкой) должен сменить халат и одеть специальный фартук и стерильные перчатки. 9.9. Перед операцией (перевязкой) хирург и медсестра должны вымыть руки с мылом, стерильными щётками (или стерильными салфетками) в течение 1 минуты, затем обработать их антисептическими средствами и надеть стерильные хирургические перчатки. Ногти персонала должны быть коротко подстрижены. На руках не должны быть украшения. 9.10. После каждого больного руки необходимо мыть и обрабатывать заново, операционный стол дважды протирается дезинфицирующими средствами. 9.11. После обработки поверхностей ветошь должна простирываться, просушиваться и храниться в сухом виде. 9.12.
Медицинский инструментарий после использования сразу дезинфицируется в 0,5% хлорсодержащем растворе на 10 мин. (или другом дезинфектанте в соответствующей концентрации), промывается водой и сдается в ОЦС для проведения предстерилизационной очистки и стерилизации, а перевязочный материал после дезинфекции уничтожают в соответствии действующего нормативного документа. 9.13. Запрещается посещение хирургического кабинета персоналом других кабинетов, подразделений поликлиник, пребывание персонала хирургических кабинетов в других кабинетах, подразделениях поликлиники, на территории вокруг поликлиники, в т.ч. санитарно-дворовых установок, на улице в специальной одежде. При необходимости выхода из кабинетов, персонал обязан снять спец. одежду. 9.14.
Для верхней одежды пациентов хирургического кабинета в поликлинике предусматривается гардеробная, в кабинете - специально выделенная вешалка. 9.15.
Весь инвентарь, оборудование, спец. одежда и другие предметы хирургического кабинета должны быть промаркированы и использоваться строго по назначению. 9.16. В хирургическом кабинете 3 раза в день проводится текущая уборка, в том числе 1 раз с применением дезинфицирующих средств. 9.17. Генеральная уборка проводится 1 раз в неделю в соответствии с прил. 3 настоящих санитарных правил. 9.18. Лабораторией территориального ЦГСЭН 1 раз в квартал осуществляется бактериологические исследования объектов внешней среды на бактериальную загрязненность, на стерильность хирургического инструментария и перевязочных материалов. ^
10. Учет и регистрация внутрибольничных инфекций (ВБИ)
в хирургических стационарах (отделениях)
10.1. Современные внутрибольничные инфекции в хирургических стационарах (отделениях) вызываются различными микроорганизмами и клинически проявляются в основном синдромом нагноений и септических поражений. В зависимости от локализации возбудителя выделение его из организма больного или носителя происходит через различные органы и ткани (дыхательные пути, желудочно-кишечный тракт, мочеполовой тракт и т.д.). 10.2. При хирургическом вмешательстве отмечаются следующие виды инфекций: А) поверхностная инфекция разреза
возникает не позднее 30 дней после операции и вовлекает только кожу и подкожные ткани в области разреза; у пациента имеется одно из перечисленного: Гнойное отделяемое из поверхностного разреза; Выделение микроорганизмов из жидкости или ткани, полученной асептически пункцией области поверхностного разреза или из раны при наличии микроскопических признаков гнойного воспаления; Имеется не менее двух из следующих симптомов: боль или болезненность; ограниченная припухлость; краснота; местное повышение температуры. Диагноз ставится хирургом или другим лечащим врачом (нагноение послеоперационной раны и другие); Б) глубокая инфекция в области хирургического вмешательства
возникает не позднее 30 дней после операции при отсутствии имплантата или не позднее одного года при наличии имплантата в месте операции и вовлекает глубокие мягкие ткани (например, фасциальный и мышечный слой) в области разреза; у пациента имеется хотя бы одно из перечисленного: Гнойное отделяемое из глубины разреза в месте данного хирургического вмешательства, но не из органа/полости; Выделение микроорганизмов из жидкости или ткани, полученное асептически пункцией области глубокого разреза или из мазка из глубины раны при наличии микроскопических признаков гнойного воспаления; Спонтанное расхождение краев раны или намеренное ее открытие хирургом, когда у пациента имеются следующие признаки и симптомы: лихорадка (> 37,5 С), локализованная боль или болезненность; При непосредственном осмотре, во время повторной операции, при гистологическом или рентгенологическом исследовании обнаружен абсцесс или иные признаки инфекции в области глубокого разреза. Диагноз ставится хирургом или другим лечащим врачом (абсцесс, флегмона и другие); В) инфекция полости/органа
возникает не позднее 30 дней после операции при отсутствии имплантата или не позднее одного года при наличии имплантата в месте операции, вовлекает любую часть организма (например, органа или полости), кроме области разреза, которая была вскрыта или подверглась манипуляциям в процессе операции; у пациента имеется одно из перечисленного: Гнойное отделяемое из дренажа, установленного в органе/полости через специальный разрез; Выделение микроорганизмов из жидкости или ткани, полученной асептически из органа/полости; Лихорадочное состояние; При непосредственном осмотре, во время повторной операции, при гистологическом или рентгенологическом исследовании обнаружен абсцесс или иные признаки инфекции, вовлекающие орган/полость. Диагноз ставится хирургом или другим лечащим врачом (перитонит, остеомиелит, пневмония, пиелонефрит, медиастенит, эндометрит и другие, возникшие после операции на соответствующем органе). 10.3. К внутрибольничным послеоперационным инфекциям относятся заболевания, возникающие в течение 30 дней после оперативного вмешательства, а при наличии имплантата в месте операции – до года. 10.4. Поскольку ВБИ развиваются и выявляются не только во время пребывания больного в стационаре, но и после выписки или перевода в другой стационар и характеризуются многообразием клинических проявлений, организация сбора информации осуществляется не только в стационарах, но и в других ЛПУ. 10.5. Врач-эпидемиолог лечебного учреждения совместно с заведующими структурными подразделениями проводит активное выявление ВБИ путем проспективного наблюдения, оперативного и ретроспективного анализа. 10.6. Общие требования к микробиологическому обеспечению эпидемиологического надзора: Результаты микробиологических исследований необходимы для осуществления эффективного эпидемиологического надзора. При проведении клинических и санитарно-бактериологических исследований должны преобладать исследования по клиническим показаниям, которые должны проводиться микробиологическими лабораториями ЛПУ, направленные на расшифровку этиологии ВБИ и определение тактики лечения. Объем санитарно-бактериологических исследований определяется эпидемиологической необходимостью. 10.7. Возникновение или подозрение на ВБИ у пациента и персонала является показанием к проведению микробиологических исследований. 10.8. Забор материала следует проводить непосредственно из патологического очага до начала антибактериальной терапии, а также во время операции по поводу гнойных процессов. 10.9. Забор и транспортирование клинического материала на микробиологические исследования осуществляются в соответствии с техникой сбора и транспортирования биоматериалов в микробиологические лаборатории. 10.10. При вяло текущих гнойно-воспалительных ранах, свищевых ходах и других проявлениях целесообразно проводить обследования пациентов на актиномицеты, дрожжевые и плесневые грибы. 10.11. К клиническому образцу должно быть приложено направление, содержащее сведения: характер материала, фамилия, имя, отчество и возраст больного, название отделения, номер истории болезни, диагноз заболевания, дата и время взятия материала, данные о ранее проводимой антибактериальной терапии, подпись врача, направляющего материал на анализ. 10.12. Микробиологическая лаборатория представляет лечащему врачу и эпидемиологу информацию для дальнейшего анализа:
количество клинических образцов, направленных на исследование из каждого отделения;
количество выделенных и идентифицированных микроорганизмов, включая грибы (отдельно по каждому из видов);
количество выделенных микробных ассоциаций;
количество микроорганизмов, тестированных на чувствительность к каждому из антибиотиков;
чувствительность выделенных микроорганизмов к антибиотикам и другим антимикробным средствам.
10.13. Необходимо обращать особое внимание на метициллин (оксациллин) резистентные стафилококки, ванкомицинрезистентные энтерококки, микроорганизмы с множественной лекарственной устойчивостью для проведения целенаправленных лечебных, профилактических и противоэпидемических мероприятий.10.14. При расследовании вспышек для успешного выявления источников инфекции, путей и факторов передачи проводят внутривидовое типирование микроорганизмов, выделенных от больных, медицинского персонала, объектов окружающей среды. 10.15. Лабораторное исследование объектов окружающей среды в ЛПУ проводят в соответствии с санитарными правилами по организации и проведению производственного контроля за соблюдением санитарно-гигиенических, профилактических и противоэпидемических мероприятий по разработанному плану производственного контроля, обращая особое внимание на контроль стерильности инструментов, инъекционных растворов, перевязочного и шовного материала. 10.16. Оперативный и ретроспективный анализ предусматривает изучение заболеваемости ВБИ по локализации патологического процесса, этиологии и срокам их развития. 10.17. Оперативный (текущий) анализ заболеваемости ВБИ проводят на основании данных ежедневного учета по первичным диагнозам. 10.18. В ходе оперативного анализа заболеваемости проводится оценка текущей эпидемиологической обстановки и решается вопрос о благополучии или осложнении в эпидемиологическом плане, адекватности проводимых мер или необходимости их коррекции. 10.19. Анализ заболеваемости ВБИ проводится с учетом:
сроков возникновения заболевания после операции;
места проведения операции (номер операционной);
длительности операции;
времени, прошедшего с момента поступления до операции;
продолжительности пребывания в стационаре;
профилактического применения антибиотиков;
типа чистоты операции (класса раны);
оценки тяжести состояния пациента.
10.20. Ретроспективный анализ заболеваемости ВБИ предусматривает:
анализ многолетней динамики заболеваемости с определением тенденции (рост, снижение, стабилизация) и темпов роста или снижения;
анализ годового, помесячного уровней заболеваемости;
сравнительную характеристику заболеваемости по отделениям;
изучение структуры заболеваемости по локализации патологического процесса и этиологии;
анализ оперативных вмешательств;
распределение заболеваемости по срокам клинических проявлений (во время пребывания в стационаре и после выписки);
анализ данных о формировании госпитальных штаммов;
определение удельного веса вспышечной заболеваемости в общей структуре ВБИ;
анализ летальности (по локализации патологического процесса и этиологии), уровень летальности и удельный вес умерших от ВБИ.
10.21. Ретроспективный анализ заболеваемости ВБИ у пациентов выявляет фоновый уровень заболеваемости, основные источники инфекции, ведущие факторы передачи и является основой для разработки профилактических и противоэпидемических мероприятий, адекватных конкретной эпидемиологической обстановке в данном стационаре (отделении).10.22. Для корректного сравнения показателей частоты послеоперационных инфекционных заболеваний их расчет проводится с учетом основных факторов риска: типа операции, длительности операции, тяжести состояния пациента. Не рекомендуется сравнение абсолютного количества ВБИ, а также интенсивных показателей, рассчитанных на 100 операций без учета факторов риска. 10.23. Ретроспективный анализ заболеваемости медицинского персонала позволяет определить круг источников инфекции и провести мероприятия, направленные на ограничение их роли в заносе в лечебное учреждение и распространении ВБИ. 10.24. В зависимости от степени контаминации раны во время операции выделяют:
чистые раны (неинфицированные операционные раны без признаков
воспаления);
условно чистые раны (операционные раны, проникающие в дыхательные пути, пищеварительный тракт, половые или мочевыводящие пути при отсутствии необычного заражения);
загрязненные (контаминированные) раны (операционные раны со значительным нарушением техники стерильности или со значительной утечкой содержимого из желудочно-кишечного тракта);
грязные (инфицированные) раны (операционные раны, в которых микроорганизмы, вызвавшие послеоперационную инфекцию, присутствовали в операционном плане до начала операции).
10.25. Риск развития ВБИ для чистых ран составляет 1-5 %, для условно чистых – 3-11 %, для загрязненных – 10-17 % и для грязных – более 25-27 %. 10.26. Помимо интенсивных показателей заболеваемости рассчитывают показатели, позволяющие определить действие ряда факторов риска (стратифицированные показатели), – частоту инфекций: Нижних дыхательных путей на 1 000 пациенто-дней искусственной вентиляции легких и структуру их (у пациентов, подвергавшихся искусственной вентиляции легких (ИВЛ); Кровотока на 1 000 пациенто-дней сосудистых катетеризаций и структуру их (у пациентов, подвергавшихся катетеризации сосудов); Мочевыводящих путей на 1 000 пациенто-дней уринарных катетеризаций и структуру их (у пациентов, подвергавшихся катетеризации мочевого пузыря). 10.27. В целях недопущения возникновения вспышек ВБИ важное значение придается их выявлению и учету. 10.28. Учету и регистрации подлежат заболевания и осложнения в соответствии с международной статистической классификацией болезней, травм и состояний, влияющих на здоровье, 10-го пересмотра (далее МКБ-10). 10.29. Единичные случаи локальных форм ГСИ расследует эпидемиолог ЛПУ, который определяет, проводит и контролирует проведение профилактических и противоэпидемических мероприятий в полном объеме. При отсутствии эпидемиолога стационара расследования проводит зам. главврача ЛПУ по лечебной работе. Острые инфекционные заболевания (сальмонеллезы, дизентерии, геморрагические лихорадки, внутрибольничные ВГВ И ВГС и др.) и генерализованные формы ГСИ (сепсис, остеомиелит и др.) проводит врач эпидемиолог территориального ЦГСЭН. 10.31. Специалист, выявивший случай ВБИ, формулирует диагноз в соответствии с международной статистической классификацией болезней, травм и состояний, влияющих на здоровье, 10-го пересмотра, регистрирует в журнале учета инфекционных заболеваний. ^
Перечень регистрируемых нозологических форм
послеоперационных инфекций
Наименование заболевания
|
Шифр по МКБ-10
|
вирусные и бактериальные пневмонии
|
J12-J15
|
стрептококковая септицемия
|
A40
|
другая септицемия, в том числе:
|
A41
|
сепсис
|
А41.8
|
газовая гангрена
|
A48.0
|
бактериальный менингит, менингоэнцефалит и менингомиелит
|
G00, G04.2
|
энцефалит, миелит или энцефаломиелит неуточненный
|
G04.9
|
флебит и тромбофлебит
|
180
|
острый перитонит
|
K65.0
|
остеомиелит
|
M86
|
неудачный медицинский аборт, осложнившийся инфекцией половых путей и тазовых органов
|
О07.0
|
расхождение краев операционной раны, не классифицированное в других рубриках
|
T81.3
|
инфекция, связанная с процедурой, не классифицированная в других рубриках (серомы, инфильтраты и др.)
|
Т81.4
|
инфекция, связанная с протезом сердечного клапана, другими сердечными и сосудистыми устройствами, имплантатами и трансплантатами
|
Т82.6,7
|
инфекции, обусловленные протезным устройством,
имплантатом, трансплантатом в мочеполовой системе
|
Т83.5,6
|
инфекции, обусловленные эндопротезированием, внутренним фиксирующим устройством, внутренними протезными устройствами, имплантатами, трансплантатами
|
Т84.5,6,7
|
инфекция ампутированной культи
|
Т87.4
|
инфекция и воспалительная реакция, обусловленные другими внутренними протезными устройствами, имплантатами и трансплантатами
|
Т85.7
|
инфекции, связанные с инфузией, трансфузией и лечебной инъекцией
|
T80.2
|
острый цистит
|
N30.0
|
уретральный абсцесс
|
N34.0
|
инфекции мочевыводящих путей без установленной локализации
|
N39.0
|
другие инфекционные заболевания, носительство возбудителей инфекционных заболеваний, возникшие во время пребывания в лечебной организации
|
обозначаются кодами по МКБ-10 соответственно нозологической форме
|
10.32. О каждом случае ВБИ выявленного у больного в ЛПУ направляется экстренное извещение ф. 058/у в территориальный Центр Государственного санитарно-эпидемиологического надзора, в установленном порядке. 10.33. Групповыми заболеваниями следует считать появление 3 и более случаев внутрибольничных заболеваний, связанных одним источником инфекции и общими факторами передачи. О возникновении групповых заболеваний в ЛПУ территориальный ЦГСЭН представляет внеочередное донесение в вышестоящие организации, осуществляющие государственный санитарно-эпидемиологический надзор с отражением необходимого объема информаций. 10.34. Объем противоэпидемических мероприятий в случае регистрации вспышечной ситуации определяет специалист ЦГСЭН при проведении эпидемиологического расследования. 10.35. Ответственность за своевременность и полноту информации о каждом случае ВБИ возлагается на руководителя лечебно-профилактического учреждения. |
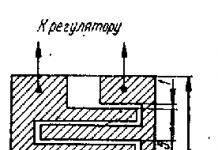
Инструментарий и отдельные части аппаратуры, применяемые в анестезиологической практике, подлежат стерилизации. Но иногда приходится иметь дело с таким материалом и инструментарием, который общепринятым способом простерилизовать не всегда удается.
Самым простым и надежным считается кипячение или автоклавирование. Но тут приходится сталкиваться с рядом трудностей. Дело в том, что трубки и другие резиновые предметы при такой стерилизации теряют гибкость, эластичность и быстро выходят из строя. Некоторые же части аппарата практически недоступны обработке.
В последнее время предложен ряд методов, обеспечивающих стерильность предметов, не оказывая существенного влияния на их качество. Речь о них будет вестись ниже.
Обеззараживание наркозного аппарата
Наркозный аппарат представляет собой полую воздухопроводящую систему, которая находится в тесном контакте с дыхательными путями больного. При недостаточной обработке аппарата и вспомогательного инструментария, соприкасающегося с больным, инфекция может быть занесена следующему больному.
Обеззараживание наркозного аппарата должно начинаться с тщательной механической очистки, которую следует проводить сразу после окончания наркоза. Резиновые части аппарата, а также металлические тройники, адаптеры и другие съемные предметы нужно тщательно промыть под проточной теплой водой с мылом. При этом не рекомендуется пользоваться щетками или «ершами», так как без предварительного кипячения они сами являются источником дополнительного инфицирования. Кроме того, в патрубках воздухопроводящей системы аппарата от щеток и «ершей» оставшиеся щетинки могут попасть в дыхательные пути больного.
После мытья и прополаскивания резиновые шланги, мешки, а также металлические присоединительные элементы (тройники, угловые трубки, адаптеры) подвергаются химической дезинфекции. Дезинфицирующие средства должны отвечать ряду требований:
- давать надежный эффект;
- не оказывать вредного влияния на слизистую оболочку дыхательных путей;
- не разрушать дезинфицирующие детали;
- быть доступными и простыми в употреблении.
Одним из наилучших дезинфицирующих средств является этиловый спирт. Погружение указанных выше деталей на 20-30 минут в 70° этиловый спирт дает хороший обеззараживающий эффект. После использования спирт может быть сохранен для повторного обеззараживания.
Возникает вопрос, как часто должны дезинфицироваться наркозные аппараты и инструментарий?
Резиновые детали и присоединительные элементы аппарата должны обязательно подвергаться дезинфекции особенно после наркотизирования больного, страдающего инфекционным заболеванием легкого. После больных со здоровой дыхательной системой допускается периодическая дезинфекция наркозного аппарата (примерно один раз в неделю). А механическая чистка - мытье частей и деталей аппаратов-должна производиться после каждого наркоза.
Если операция производилась по поводу эхинококка легкого или у наркотизируемого была активная форма туберкулеза, то после обмывания теплой водой с мылом эндотрахеальные трубки, маски, переходники, мешок и другие подсобные инструменты нужно обработать формалином, а затем кипятить в течение 3 минут.
Стерилизация интубационных трубок
Интубационные трубки после употребления отделяют от переходника, тщательно промывают горячей водой с мылом, обращая особое внимание на чистоту внутренней поверхности. Для очистки ее удобнее пользоваться специальной щеткой или проволочным мандреном. В петлю на конце мандрена вставляют марлевый тампон, смоченный теплой водой и намыленный мылом. Мандрен вводится в трубку, и внутренняя поверхность ее таким образом хорошо очищается от слизи, крови, гноя и т. п.
После мытья трубка тщательно ополаскивается под сильной струей воды и насухо протирается марлей, смоченной эфиром.
Стерилизация интубационных трубок может осуществляться одним из многих существующих способов - кипячением, хранением в спирте различной концентрации, в растворе сулемы, фурацеллина, риваноля и др. Однако, какой бы из этих методов ни применялся, по окончании наркоза трубка тщательно промывается, как сказано выше, а затем стерилизуется.
Кипячение - самый надежный способ стерилизации, однако он отражается на качестве резины. Трубки становятся менее эластичными - деформируются.
Одним из методов стерилизации является следующий: после тщательного промывания трубку на 4-5 минут погружают в кипящую воду или кладут на 2 часа в 70° спирт.
По другой методике трубки после экстубации моются также под проточной водой с мылом и внутри и снаружи, затем просушиваются и протираются раствором сулемы (1:5000) или 2% раствором хлорамина. После этого трубки ополаскивают водой и протирают 96º спиртом.
Практически трубки используются на следующий день, поэтому некоторые из них до употребления хранят в сухом виде в стерильном биксе или в растворе фурацеллина (5:5000). Лучше содержать трубки в круглой стеклянной банке, что сохраняет необходимую кривизну их.
Перед употреблением после проверки просвета трубки и целости манжетки трубку следует многократно протереть марлей, смоченной 70° спиртом, и дать просохнуть. Перед интубацией трахеальный конец трубки для облегчения введения рекомендуется смазать 1% дикаиновой мазью на глицерине или просто чистым глицерином. Достоинством глицерина является легкая смываемость его водой. При этом трубка не подвергается порчи.
Воздуховоды, зубные распорки, угловые трубки, металлические инструменты и т. д.
стерилизуются кипячением или автоклавированием. Предварительно все эти предметы также подвергаются тщательному промыванию под струей горячей воды с мылом. Затем они просушиваются и протираются 70″ спиртом. Стерилизация высокой температурой не отражается на качестве этих предметов.
Стерилизация ларингоскопа
представляет более трудную задачу. Существуют различные способы ее. Если лампочка и электропроводка у ларингоскопа съемные, то их снимают, а ларингоскоп кипятят. Профессор Мешалкин предлагает мыть клинок ларингоскопа в проточном 95% растворе нашатырного спирта, а затем протирать его 70° спиртом.
Другой способ стерилизации ларингоскопа заключается в том, что вначале во избежание повреждения осветительные части протирают влажной, хорошо отжатой марлей, а затем сулемой (1:5000) или 2% раствором хлорамина, после чего обрабатывают 96° спиртом. Клинки ларингоскопа и тубусы бронхоскопа после промывания погружают в раствор фурацеллина (1:5000). Перед употреблением протирают стерильной салфеткой.