Диагностика инфаркта миокарда базируется
На классическом ишемическом болевом синдроме (или дискомфорте в груди),
Типичных изменениях ЭКГ при ее динамическом регистрировании (у половины больных, доставленных в больницу с болями в сердце и подозрением на инфаркте миокарда, выявляется малодиагностичная ЭКГ),
Достоверных изменениях (повышении, а потом нормализации) уровней кардиоспецифических ферментов в сыворотке крови,
Неспецифических показателях тканевого некроза и воспаления (резорбционном синдроме),
Данных ЭхоКГ и сцинтиграфии сердца
В большинстве случаев инфаркта миокарда ставится уже на основании клинической картины, еще до снятия ЭКГ ЭКГ позволяет ставить диагноз инфаркта миокарда в 80% случаев, но все же она больше пригодна для уточнения локализации и давности ИМ, чем для определения размеров очага некроза (многое зависит от того, когда ЭКГ снимают) Нередко отмечается отсроченное появление изменений на ЭКГ Так, в ранний период инфаркта миокарда (первые часы) параметры ЭКГ могут быть нормальными или их трудно интерпретировать.
Даже при явном инфаркте миокарда может не быть повышения интервала ST и формирования патологического зубца Q. Поэтому необходим анализ ЭКГ в динамике. Снятие ЭКГ в динамике в период ишемической боли поможет оценить эволюцию изменений у большей части больных. Следовательно, каждому больному с болями в грудной клетке, которые потенциально могут быть сердечными, надо в течение 5 мин записывать ЭКГ и немедленно ее оценивать в целях установления показаний для проведения реперфузионного лечения Если на ЭКГ имеется «свежее» повышение сегмента ST или «новая» блокада ЛНПГ, то это показание для проведения адекватной реперфузии с помощью системного тромболизиса или ПЧКА Если в анамнезе имеются указание на ИБС (ишемию миокарда), а ЭКГ не дает оснований для реперфузионной терапии, то у больного следует предположить НСт или инфаркта миокарда без повышения интервала ST
Критерии «свежего» инфаркта миокарда - типичное повышение и постепенное снижение биохимических маркеров некроза миокарда (тропонинового теста) или более быстрое повышение и снижение МВ-КФК в сочетании как минимум с одним из следующих признаков ишемические симптомы, появление патологического зубца Q на ЭКГ, изменения на ЭКГ, указывающие на ише мию (характерное повышение или снижение интервала ST), проведение коронарной интервенции (ангиопластики), анато-мо-патологические признаки «свежего» инфаркта миокарда.
Как показывает практика, почти у половины больных инфарктом миокарда наблюдается безболевое начало болезни (или нетипичное проявление болевого синдрома) и отсутствуют четкие (однозначно трактуемые) характерные изменения ЭКГ
Ведущие ЭКГ-критерии инфаркта миокарда.
1) инверсия зубца Т, указывающая на ишемию миокарда Часто эти острейшие изменения врач пропускает,
2) в острейший период формируется высокий остроконечный зубец Т (ишемия) и повышение сегмента ST (повреждение), которое имеет выпуклую (или косовосходящую) форму, может сливаться с зубцом Т, образуя монофазную кривую (свидетельствуя о повреждении миокарда) Изменение конечной части желудочкового комплекса (подъем или депрессия интервала ST и последующая инверсия зубца Т) может быть проявлениями мелкоочагового инфаркта миокарда (инфаркта миокарда без Q).
Для утверждения диагноза инфаркта миокарда без Q нужно повышение ферментов (желательно кардиоспецифичных) не менее чем в 1,5-2 раза Без этого диагноз ИМ остается предположительным,
3) подъем интервала ST на 2 мм и более как минимум в двух соседних отведениях (часто сочетается с «зеркальным» снижением интервала ST в отведениях от противоположной стенки сердца),
4) эволюция патологического зубца Q (более 1/4 от амплитуды R в отведениях V1-6 и avL, более 1/2 от амплитуды R во II, III отведениях и avF, интервала QS в V2-3 на фоне отрицательного Т, Q более 4 мм в V4-5). указывающая на гибель клеток миокарда Появление патологического зубца Q (возникает через 8-12 ч после появления симптоматики, но может быть и позднее) типично для крупноочагового ИМ (с зубцами Q и R) и трансмурального (QS) Нередко у больных с Q и подъемом интервала ST в одной зоне определяется снижение интервала ST в других (неинфарктных) зонах (ишемия на расстоянии, или реципропный электрический феномен).
ЭКГ-критерии диагностики инфаркта миокарда с повышением интервала ST — наличие на фоне боли в грудной клетке и любого из перечисленных ниже признаков:
Новый или предположительно новый патологический зубец Q по крайней мере в 2 отведениях из следующих: II, III, V1-V6 или I и avL;
Новая или предположительно новая элевация или депрессии интервала ST-T;
Новая полная блокада левой ножки пучка Гиса.
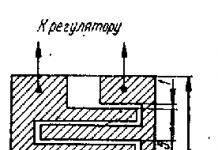
Инфаркт миокарда (нередко возникает на фоне нижнего инфаркта миокарда) плохо диагностируется на обычной ЭКГ, поэтому нужно ЭКГ-картирование или снятие ЭКГ в правых грудных отведениях (V3r-V4r), дополнительно учитывается повышение сегмента ST более 1 мм в V1 (иногда в V2-3). В первые дни ИМ необходимо проводить Хм ЭКГ. В последующие дни острого периода ЭКГ записывается ежедневно.
При мелкоочаговом инфаркте миокарда его периоды по ЭКГ трудно определить практически.
Диагностические критерии инфаркта миокарда
Прочитайте:
Повышение и (или) последующее снижение уровня биохимических маркеров некроза миокарда в крови (предпочтительно сердечных тропонинов), если их концентрация как минимум в одной пробе крови превышает верхнюю границу нормы, принятую в данной лаборатории, и имеется как минимум одно из следующих свидетельств ишемии миокарда:
Клиническая картина ишемии миокарда;
Изменения ЭКГ, указывающие на появление ишемии миокарда (возникновение смещений сегмента ST-T, блокады левой ножки пучка Гиса);
Появление патологических зубцов Q на ЭКГ;
Появление признаков потери жизнеспособного миокарда или нарушений локальной сократимости при использовании методик, позволяющих визуализировать сердце.
Формулировка развернутого клинического диагноза ИМ должна отражать:
Характер течения (первичный, рецидивирующий, повторный);
Глубину некроза (ИМ с зубцом Q, или ИМ без зубца Q);
Локализацию ИМ;
Дату возникновения ИМ;
Осложнения (если они имелись): нарушения ритма и проводимости, острая сердечная недостаточность и др.;
Фоновые заболевания — атеросклероз коронарных артерий (если выполнялась коронароангиография, то указывается его тяжесть, распространенность и локализация), ГБ (при ее наличии) и ее стадия, сахарный диабет и др.
Оказание помощи больным с ИМпST складывается из системы организационных и лечебных мероприятий.
Организационные мероприятия включают:
— раннюю диагностику врачами скорой медицинской помощи, участковыми врачами, терапевтами и врачами общей практики районных поликлиник ОКСпST на основании критериев, приведенных ранее (см. ОКСпST);
— как можно более раннюю госпитализацию бригадой скорой помощи больного с ОКСпST в блок интенсивной кардиологии отделения неотложной кардиологии;
— как можно более раннее начало мероприятий, направленных на восстановление коронарного кровотока: выполнение первичных ЧКВ в течение 90 мин от момента поступления больного в стационар, располагающий такими возможностями, или введение тромболитических препаратов на догоспитальном этапе либо не позднее 30 мин от момента поступления больного в стационар, не располагающий возможностями выполнения первичных ЧКВ;
— пребывание больного в течение острого периода ИМпST в блоке интенсивной кардиологии;
— систему восстановительного лечения (реабилитация).
Лечебные мероприятия проводятся с учетом стадии ИМпST, выраженности и характера осложнений.
В начальном периоде ИМпST основные лечебные мероприятия направлены на обезболивание, скорейшее полноценное и стойкое восстановление коронарного кровотока в инфаркт-связанной артерии и лечение осложнений, если они возникают.
Купирование болевого синдрома. Обезболивание является одной из важнейших задач начального периода лечения больных с ИМпST. При неэффективности 1-2-кратного приема 0,4 мг нитроглицерина в виде таблеток или спрея, используют внутривенное введение наркотических анальгетиков, среди которых наиболее эффективен 1% раствор морфина (морфина гидрохлорида). Обычно внутривенно струйно (медленно!) вводят 1,0 мл препарата, разведенного в 20,0 мл изотонического раствора натрия хлорида. Вместо морфина могут быть использованы и другие наркотические анальгетики: 1,0 мл 1% раствора тримеперидина (промедола *), 1-2 мл 0,005% раствора фентанила, как в сочетании с транквилизаторами или нейролептиками (2 мл 0,25% раствора дроперидола), так и без них.
Оксигенотерапия через лицевую маску либо носовые катетеры показана больным, имеющим одышку или клинические признаки острой сердечной недостаточности (отек легких, кардиогенный шок).
Восстановление коронарного кровотока и перфузии миокарда. Скорейшее восстановление кровотока в окклюзированной коронарной артерии (реперфузия) служит краеугольной задачей в лечении больных с ИМпST, решение которой влияет как на госпитальную смертность, так и на ближайший и отдаленный прогноз. При этом желательно, чтобы, помимо как можно более быстрого, восстановление коронарного кровотока было полноценным и стойким. Ключевым моментом, влияющим как на эффективность любого реперфузионного вмешательства, так и на его отдаленные результаты, является фактор времени: потеря каждых 30 мин увеличивает риск смерти в стационаре примерно на 1%.
Существует две возможности восстановления коронарного кровотока: тромболитическая терапия, т.е. реперфузия с помощью тромболитических препаратов (стрептокиназа, тканевые активаторы плазминогена), и ЧКВ, т.е. реперфузия с помощью механического разрушения тромботических масс, окклюзирующих коронарную артерию (баллонная ангиопластика и стентирование коронарных артерий).
Попытка восстановления коронарного кровотока с помощью того или другого метода должна быть предпринята у всех больных с ИМпST в первые 12 ч заболевания (при отсутствии противопоказаний). Реперфузионные вмешательства оправданы и после 12 ч от начала заболевания, если имеются клинические и ЭКГ-признаки продолжающейся ишемии миокарда. У стабильных больных, при отсутствии клинических и ЭКГ-признаков продолжающейся ишемии миокарда, проведение ни тромболитической терапии, ни ЧКВ позднее 12 ч от начала заболевания не показано.
В настоящее время методом выбора восстановления коронарного кровотока у больных с ИМпST в первые 12 ч заболевания служит первичное ЧКВ (рис. 2-19).

Рис. 2-19. Выбор реперфузионной стратегии лечения больных с инфарктом миокарда с подъемом сегмента ST в первые 12 ч заболевания
Под первичным ЧКВ понимают баллонную ангиопластику со стентированием (либо без него) инфаркт-связанной коронарной артерии, выполненные в первые 12 ч от начала клинической картины ИМпST без предшествующего применения тромболитических либо других препаратов, способных растворять тромбы.
В идеальном случае в первые 12 ч заболевания больной с ИМпST должен быть доставлен в стационар, располагающий возможностями выполнения первичного ЧКВ 24 часа в сутки 7 дней в неделю при условии, что предполагаемые потери времени между первым контактом пациента с врачом и моментом раздувания баллонного катетера в коронарной артерии (т.е. момента восстановления коронарного кровотока) не превысят 2 ч. У больных с обширным ИМпST, диагностированным в первые 2 ч от начала заболевания, потери времени не должны превышать 90 мин.
Однако в реальной жизни далеко не у всех больных с ИМпST возможно выполнение первичного ЧКВ, поскольку, с одной стороны, по различным причинам в первые 12 ч заболевания госпитализируются значительно менее 50% больных, а в первые 6 ч, наиболее благоприятных для лечения, — менее 20% больных с ИМпST. С другой стороны, далеко не все крупные стационары имеют возможность выполнения экстренных ЧКВ 24 часа в сутки 7 дней в неделю.
В связи с этим во всем мире, в том числе и в Российской Федерации, основным способом восстановления коронарного кровотока у больных с ИМпST пока остается тромболитическая терапия. К преимуществам тромболитической терапии относится простота ее проведения, относительно невысокая стоимость, возможность ее проведения как на догоспитальном этапе (существенное, не менее чем на 30 мин (!) сокращение времени до начала реперфузионной терапии), так и в любом стационаре. К ее недостаткам следует отнести недостаточную эффективность (50-80% в зависимости от типа тромболитического препарата и времени, прошедшего от начала заболевания), развитие ранних (5-10% больных) и поздних (30% больных) повторных окклюзий коронарных артерий, возможность тяжелых геморрагических осложнений, включая геморрагический инсульт (у 0,4-0,7% больных).
При отсутствии противопоказаний проведение тромболитической терапии должно быть осуществлено в первые 12 ч от начала клинической картины ИМпST у больных, которым первичное ЧКВ по каким-либо причинам не может быть выполнено в указанные выше интервалы времени.
Принципиально важным является положение, что проведение системного тромболизиса целесообразно только в первые 12 ч от начала клинической картины ИМпST.
В более поздние сроки проведение системного тромболизиса не показано, поскольку эффективность его крайне низкая, и он не оказывает существенного влияния на показатели госпитальной и отдаленной смертности.
В настоящее время наиболее широко используемыми тромболитическими препаратами являются стрептокиназа (самый часто используемый в мире препарат) и тканевые активаторы плазминогена, к которым относятся алтеплаза (t-PA), ретеплаза (rt-PA) и тенектеплаза (nt-PA), проурокиназа (пуролаза).
Преимущество имеют тканевые активаторы плазминогена, поскольку они являются фибринспецифичными тромболитическими препаратами.
При наличии обученного персонала рекомендуется начинать тромболитическую терапию на догоспитальном этапе в условиях бригады скорой помощи, что позволяет значительно (минимум на 30-60 мин) сократить потери времени, связанные с проведением реперфузионных вмешательств.
Показания к проведению системного тромболизиса:
Наличие типичной клинической картины острого коронарного синдрома в сочетании с изменениями ЭКГ в виде подъема сегмента ST >1,0 мм в 2 смежных стандартных отведениях от конечностей либо подъема сегмента ST >2,0 мм в двух смежных грудных отведениях и более;
Впервые выявленная полная блокада левой ножки пучка Гиса в сочетании с типичной клинической картиной.
К абсолютным противопоказаниям
Геморрагический инсульт или инсульт неизвестного характера любой давности в анамнезе;
Ишемический инсульт в течение последних 6 мес;
Наличие сосудистой патологии головного мозга (артериовенозная мальформация);
Наличие злокачественной опухоли головного мозга или метастазов;
Недавняя травма, в том числе черепно-мозговая, полостная операция, в течение последних 3 нед;
Желудочно-кишечное кровотечение в течение последнего 1 мес;
Известные заболевания, сопровождающиеся кровоточивостью;
Подозрение на расслоение стенки аорты;
Пункции неподдающихся компрессии органов (пункция печени, люмбальная пункция), в том числе сосудов (подключичная вена).
К относительным противопоказаниям к проведению системного тромболизиса относятся:
Транзиторная ишемическая атака в течение последних 6 мес;
Терапия непрямыми антикоагулянтами;
Беременность и 1-я неделя после родов;
Реанимационные мероприятия, сопровождавшиеся травмой грудной клетки;
Неконтролируемая АГ (систолическое АД >180 мм рт.ст.);
Язвенная болезнь желудка и двенадцатиперстной кишки в фазе обострения;
Далеко зашедшие заболевания печени;
Стрептокиназу вводят внутривенно капельно в дозе 1,5 Ед, растворенные в 100 мл 0,9% раствора натрия хлорида или 5% глюкозы* в течение 30-60 мин. Предварительно, для снижения вероятности аллергических реакций, целесообразно ввести внутривенно 60-90 мг преднизолона.
Алтеплаза вводится внутривенно в суммарной дозе 100 мг следующим образом: первоначально внутривенно в виде болюса вводят 15 мг препарата, затем в течение следующих 30 мин начинают внутривенное капельное введение алтеплазы из расчета 0,75 мг/кг массы тела, в последующие 60 мин продолжают внутривенное капельное введение препарата из расчета 0,5 мг/кг массы тела.
Тенектеплазу вводят внутривенно в виде однократной болюсной инъекции в дозе, рассчитываемой в зависимости от веса больного: при весе 60-70 кг — вводится 35 мг препарата, при весе 70-80 мг — вводится 40 мг тенектеплазы, при весе 80-90 кг — вводят 45 мг препарата, при весе более 90 кг — 50 мг.
Проурокиназа (пуролаза), отечественный препарат, вводится внутривенно (предварительно препарат растворяют в 100-200 мл дистиллированной * воды или изотоническом растворе хлорида натрия) по схеме «болюс + инфузия». Болюс составляет 2 000 000 МЕ; последующая инфузия 4 000 000 МЕ в течение 30-60 мин.
По сравнению со стрептокиназой (тромболитик 1-го поколения), алтеплазой и ретеплазой (тромболитики 2-го поколения), которые требуют внутривенного капельного введения в течение определенного времени, удобство применения тенектеплазы (тромболитик 3-го поколения) состоит в возможности его болюсного внутривенного введения. Это чрезвычайно удобно при проведении догоспитального тромболизиса в условиях бригады скорой медицинской помощи.
Косвенно эффективность тромболитической терапии оценивают по степени снижения интервала S-T (по сравнению с выраженностью первоначального подъема) через 90 мин после начала введения тромболитического препарата. Если интервал S-T снизился на 50% или более по сравнению с первоначальным уровнем, принято считать, что тромболизис оказался эффективным. Еще одним косвенным подтверждением эффективности тромболитической терапии служит появление так называемых реперфузионных аритмий (частая желудочковая экстрасистолия, пробежки медленной желудочковой тахикардии, крайне редко возникает фибрилляция желудочков). Однако необходимо отметить, что далеко не всегда формально эффективная по косвенным признакам тромболитическая терапия приводит к восстановлению коронарного кровотока (по данным коронароангиографии). Реперфузионная эффективность стрептокиназы составляет около 50%, алтеплазы, ретеплазы* 9 и тенектеплазы — 75-85%.
При неэффективности тромболитической терапии может рассматриваться вопрос о переводе больного с ИМпST в стационар, имеющий возможность проведения ЧКВ (для того чтобы в течение 12 ч от начала заболевания ему было выполнено так называемое «спасительное» ЧКВ).
В случае эффективного системного тромболизиса больному в течение ближайших 24 ч, но не ранее 3 ч от начала введения тромболитического препарата, целесообразно проведение коронароангиографии и при показаниях — выполнение ЧКВ.
С целью усиления тромболитического эффекта и предупреждения повторного тромбоза коронарной артерии (при эффективном тромболизисе) используют антитромбоцитарные препараты (ацетилсалициловую кислоту и клопидогрел) и антитромбиновые препараты (НФГ, НМГ, ингибиторы Ха-фактора).
Учитывая чрезвычайно важную роль тромбоцитов в патогенезе ОКСпST, подавление адгезии, активации и агрегации тромбоцитов служит одним из ключевых моментов в лечении этой категории больных. Ацетилсалициловая кислота, блокируя циклооксигеназу-1 тромбоцитов, нарушает синтез в них тромбоксана А2 и, таким образом, необратимо подавляет агрегацию тромбоцитов, индуцированную коллагеном, АДФ и тромбином.
Ацетилсалициловую кислоту (аспирин) в качестве антиагреганта назначают больному как можно раньше заболевания (еще на догоспитальном этапе). Первую нагрузочную дозу 250 мг больного просят разжевать; затем в дозе 100 мг больной принимает аспирин * внутрь (желательно в кишечнорастворимой форме) один раз в сутки неограниченно долго. Назначение аспирина * одновременно с проведением тромболитической терапии сопровождается снижением 35-дневной смертности на 23%.
Тиенопиридины (клопидогрел). Еще более эффективным является добавление к тромболитической терапии комбинации аспирина * и клопидогрела (как с использованием нагрузочной дозы клопидогрела 300-600 мг, так и без нее). Такая двухкомпонентная антитромбоцитарная терапия приводит к достоверному снижению на 30-й день заболевания частоты серьезных сердечнососудистых осложнений на 20%.
Антитромбиновые препараты (антикоагулянты). Целесообразность применения антикоагулянтов (НФГ, НМГ, ингибиторы Ха-фактора) связана с необходимостью сохранения проходимости и предупреждения повторного тромбоза инфарктсвязанной коронарной артерии после успешного системного тромболизиса; профилактикой формирования пристеночных тромбов в левом желудочке и последующих системных артериальных эмболий, а также профилактикой возможных тромбозов вен нижних конечностей и тромбоэмболий ветвей легочной артерии.
Выбор антикоагулянта зависит от того, проводился ли системный тромболизис или нет, и если проводился, то какой препарат использовали.
Если системный тромболизис проводили с помощью стрептокиназы, препаратом выбора среди антикоагулянтов служит ингибитор Ха-фактора фондапаринукс натрия (арикстра *), первая доза которого 2,5 мг вводится внутривенно в виде болюса, в дальнейшем он вводится подкожно 1 раз в день в дозе 2,5 мг на протяжении 7-8 дней. Помимо фондапаринукса может использоваться НМГ эноксапарин натрия, который первоначально вводят в виде внутривенного болюса в дозе 30 мг, вслед за ним с интервалом в 15 мин следует первая подкожная инъекция из расчета 1 мг/кг массы тела. В дальнейшем эноксапарин натрия вводят подкожно 2 раза в день в дозе 1 мг/кг массы тела на протяжении максимально 8 дней.
В качестве антикоагулянтной терапии может применяться и НФГ, что менее удобно, нежели эноксапарин и фондапаринукс натрия. Принципиально важен путь введения НФГ: его следует назначать исключительно (!) в виде постоянной внутривенной инфузии через дозирующие устройства под контролем АЧТВ. Цель такой терапии — достижение величины АЧТВ в 1,5-2 раза большей по отношению первоначального значения. Для этого первоначально НФГ вводят внутривенно в виде болюса 60 Ед/кг (но не более 4000 Ед), с последующей внутривенной инфузией в дозе 12 Ед/кг в час, но не превышающей 1000 Ед/ч под регулярным (через 3, 6, 12 и 24 ч после начала инфузии) контролем АЧТВ и соответствующей коррекцией дозы НФГ.
Если системный тромболизис проводили с помощью тканевого активатора плазминогена, в качестве антикоагулянтной терапии может быть использован либо эноксапарин, либо нефракционировнный гепарин.
Нитраты. Органические нитраты — препараты, уменьшающие ишемию миокарда. Однако убедительных данных в пользу применения нитратов при неосложненном течении ИМпST нет, поэтому их рутинное применение в таких случаях не показано. Внутривенное введение нитратов может применяться в течение первых 1-2 сут ИМпST при клинических признаках сохраняющейся ишемии миокарда, при высокой АГ, при сердечной недостаточности. Начальная доза препарата составляет 5-10 мкг/мин, при необходимости она увеличивается на 10-15 мкг/мин, пока не будет достигнут требуемый эффект либо систолическое АД не достигнет уровня 100 мм рт.ст.
Применение бета-адреноблокаторов на раннем этапе лечения больных с ИМпST (за счет снижения потребности миокарда в кислороде) способствует уменьшению ишемии миокарда, ограничению зоны некроза и вероятности возникновения жизнеугрожающих нарушений ритма, в том числе фибрилляции желудочков. У «стабильных» больных, не имеющих нарушений гемодинамики (артериальной гипотензии, острой левожелудочковой недостаточности), нарушений проводимости сердца, бронхиальной астмы, в первые часы ИМпST возможно внутривенное введение бета-адреноблокаторов с последующим переходом на поддерживающий прием внутрь. Однако у большинства больных, после стабилизации их состояния, предпочтительнее сразу назначение бета-адреноблокаторов (метопролол, бисопролол, карведилол, пропранолол) внутрь. При этом сначала бета-адреноблокаторы назначаются в небольшой дозе с последующем ее увеличение под контролем АД, ЧСС и состояния гемодинамики.
Ингибиторы АПФ следует назначать с первых суток ИМпST, если нет противопоказаний. Могут применяться каптоприл, эналаприл, рамиприл, периндоприл, зофеноприл, трандолаприл и др. Учитывая нестабильность гемодинамики в первые сутки ИМпST, возможность одновременного применения бета-адреноблокаторов и нитратов, первоначальные дозы ингибиторов АПФ должны быть небольшими с последующим их увеличением под контролем АД, уровня калия и креатинина плазмы крови до максимально переносимых доз либо до достижения их целевых значений. Если больной не переносит ингибиторы АПФ, можно использовать блокаторы рецепторов ангиотензина II (валсартан, лозартан, телмисартан и др). Особенно эффективны ингибиторы АПФ у больных ИМпST, у которых в ранней фазе заболевания имелось снижение фракции выброса или были признаки сердечной недостаточности.
Осложнения инфаркта миокарда и их лечение
Острая сердечная недостаточность (ОСН) — одно из наиболее грозных осложнений ИМ. Обычно она развивается при резком снижении сократимости миокарда левого желудочка вследствие обширной зоны ишемии или некроза, захватывающей более 40% миокарда левого желудочка. Нередко ОСН развивается на фоне уже имевшейся ранее хронической сердечной недостаточности либо осложняет течение повторных ИМ.
Различают два клинических варианта ОСН:
Застой крови в малом круге кровообращения, т.е. отек легких (интерстициальный либо альвеолярный);
Кардиогенный шок.
Иногда оба эти варианта ОСН сочетаются. Такие больные имеют наихудший прогноз, поскольку летальность у них превышает 80%.
Отек легких развивается вследствие повышения давления крови в капиллярах малого круга кровообращения. Это приводит к поступлению плазмы крови из внутрисосудистого русла в ткань легких, обусловливая их повышенную гидратацию. Обычно это происходит, когда гидростатическое давление в капиллярах легких повышается до 24-26 мм рт.ст. и начинает превышать величину онкотического давления крови. Различают интерстициальный и альвеолярный отек легких.
— При альвеолярном отеке жидкость, богатая белком, проникает в альвеолы и, перемешиваясь с вдыхаемым воздухом, образует стойкую пену, заполняющую дыхательные пути, резко затрудняет дыхание, ухудшает газообмен, вызывает гипоксию, ацидоз и нередко заканчивается смертью больного.
В основе кардиогенного шока лежит критическое снижение минутного выброса сердца (сердечный индекс =<1,8 л/мин в 1 м 2), сопровождающееся выраженным снижением систолического АД =<90 мм рт.ст. (на протяжении не менее 30 мин), что приводит к развитию тяжелой гипоперфузии всех органов и тканей, проявляющейся акроцианозом, олиго- и анурией (<30 мл мочи в 1 ч), гипоксией и метаболическим ацидозом. Одновременно происходит «централизация» кровообращения, при которой за счет компенсаторных механизмов, в первую очередь за счет периферической вазоконстрикции и спазма артериол в поперечно-полосатой мускулатуре, кишечнике, селезенке, печени и др. поддерживается кровообращение только в жизненно важных органах (в головном мозге, сердце и легких). Если централизация кровообращения оказывается не в состоянии обеспечить адекватную перфузию жизненно важных органов и стабилизацию АД, то длительная периферическая вазоконстрикция приводит к нарушению микроциркуляции, возникновению ДВС-синдрома, развитию ишемических некрозов в почках, кишечнике, печени, других органах. В итоге развивается полиорганная недостаточность, приводящая к смерти больного.
В зависимости от клинической картины и тяжести, ОСН у больных ИМ подразделяется на четыре класса (классификация Killip).
I класс: умеренная одышка, синусовая тахикардия при отсутствии застойных хрипов в легких.
II класс: влажные незвонкие мелкопузырчатые хрипы в нижних отделах легких не выше лопаток, захватывающие <50% поверхности легких (интерстициальный отек легких).
III класс: влажные незвонкие мелкопузырчатые хрипы, захватывающие более 50% поверхности легких (альвеолярный отек легких).
IV класс: кардиогенный шок.
Для лечения ОСН I-II класса по Killip используют:
Ингаляцию кислорода через лицевую маску либо через носовые катетеры под контролем насыщения крови кислородом;
Внутривенное введение петлевых диуретиков (фуросемид) в дозе 20-40 мг с интервалом 1-4 ч в зависимости от необходимости;
Внутривенную инфузию нитратов (нитроглицерин, изосорбида динитрат) в начальной дозе 3-5 мг/ч при отсутствии артериальной гипотензии;
Ингибиторы АПФ внутрь при отсутствии артериальной гипотензии, гиповолемии и почечной недостаточности.
Лечение больных с ОСН III класса по Killip преследует следующую цель: добиться снижения давления заклинивания в легочной артерии <20 мм рт.ст. и увеличения сердечного индекса >=2,1 л/мин в 1 м 2. что осуществляют следующим образом:
Внутривенное введение петлевых диуретиков (фуросемид) в дозе 60-80 мг и больше с интервалом 1-4 ч в зависимости от диуреза;
Наркотические анальгетики: внутривенно морфин (морфина гидрохлорид *) 1% по 1,0 мл на 20,0 мл изотонического раствора натрия хлорида;
При отсутствии артериальной гипотензии (АД >100 мм рт.ст.) внутривенная инфузия периферических вазодилататоров (нитроглицерина либо изосорбида динитрата в стартовой дозе 3-5 мг/ч с последующей коррекцией) под контролем АД и показателей центральной гемодинамики;
При наличии артериальной гипотензии (АД =<90ммрт.ст.)внутривенная инфузия инотропных препаратов — добутамина, допамина (начальная доза 2,5 мкг/кг в 1 мин с последующей коррекцией) под контролем АД и показателей центральной гемодинамики;
Лечение больных с ОСН IV класса по Killip преследует такую же цель, как и у больных с ОСН III класса по Killip, что осуществляется следующим образом:
Оксигенотерапия, мониторирование насыщения крови кислородом и величины рН;
При снижении рО 2 ниже 50% — неинвазивная (лицевая маска, CIPAP, BiPAP) либо инвазивная (интубация трахеи) вспомогательная вентиляция легких;
Мониторный контроль показателей центральной гемодинамики с помощью плавающего баллонного катетера Swan-Ganz;
Внутривенная инфузия инотропных препаратов — добутамина, допамина (начальная доза 2,5 мкг/кг в 1 мин с последующей коррекцией) под контролем АД и показателей центральной гемодинамики;
Внутриаортальная баллонная контрпульсация;
Скорейшая реваскуляризация миокарда (ЧКВ или коронарное шунтирование).
Внутриаортальная баллонная контрпульсация — один из методов вспомогательного кровообращения. Суть его заключается в том, что в нисходящую часть аорты (от уровня отхождения левой подключичной вены до уровня отхождения почечных артерий) пункционным способом через бедренную артерию вводят специальный баллонный катетер, который соединяют со специальным насосом, который синхронно с деятельностью сердца раздувает и сдувает баллонный катетер. В период диастолы баллонный катетер раздувается и перекрывает нисходящую аорту. За счет этого значительно повышается диастолическое давление в восходящей части аорты и в синусах Вальсальвы, что приводит к возрастанию коронарного кровотока, который осуществляется в основном в диастолу. Во время систолы баллонный катетер быстро сдувается, что приводит к уменьшению давления в нисходящей аорте и снижению сопротивления выбросу крови из левого желудочка. Одновременно снижается и потребность миокарда в кислороде. С помощью внутриаортальной баллонной контрпульсации у части больных с кардиогенным шоком удается улучшить гемодинамику, выиграть время и подготовить больного для проведения реваскуляризации миокарда.
Дополнительно из лекарственных препаратов в лечении кардиогенного шока применяют внутривенное введение растворов декстрана (полиглюкина *. реополиглюкина *) (либо других декстранов) и глюкокортикоидов, коррегируют кислотно-основной и электролитный баланс. Однако они влияют на вторичные механизмы патогенеза и не могут ликвидировать шок до тех пор, пока не решена основная задача — восстановление насосной функции сердца.
Ключевые слова
Статья
Цель. Оценить применение критериев диагностики инфаркта миокарда в реальной клинической практике.
Материалы и методы . Исследование проводилось с ноября по декабрь 2011 года. Были проанализированы истории болезней 67 умерших в кардиологическом отделении КБ им. С.Р. Миротворцева больных в 2009-2010 году. С помощью одномерного непараметрического анализа оценивалась взаимосвязь между всеми исследуемыми характеристиками.
Результаты. Проанализированы истории болезней 67 больных, умерших в ПИТе кардиологического отделения в возрасте от 39 до 90 лет (средний возраст 76 лет). Из них 33 мужчины (49%) и 34 женщины (51%). 21 человек (31%) находились в отделении менее 1 койко-дня, 46 человек (69%) — более 1 койко-дня. Все пациенты поступили экстренно. Скорой медицинской помощью было направлено 56 человек (83%), поликлиникой 2 человека (3%), заведующим отделением 4 человека (6%), самообращение у 1 человека (2%), из других отделений клиники 4 человека (6%). Клинику острого инфаркта миокарда имели 100% пациентов. По результатам регистрации ЭКГ у 47 пациентов (70%) было возможно определить локализацию инфаркта, у остальных - нет (вследствие выраженных рубцовых изменений, БЛНПГ). У 24 человек(36%) отмечалось поражение задней стенки левого желудочка, у 40 человек (60%) - передней стенки, у 22 человек (33%) - верхушечной и/или боковой области. У большинства пациентов имелось поражение миокарда более чем в одной зоне. Использование для диагностики биомаркеров некроза (КФК-МВ и общая КФК) было достоверно связано с длительностью госпитализации (р=0,02). Результаты исследований имелись у 9 пациентов (13%), умерших в течение первых суток госпитализации и у 33(49%), проведших в стационаре больше суток. При этом у 13 пациентов(19%), находившихся в стационаре более 24 часов, результаты данных исследований отсутствовали. У 40 пациентов (58%) повышение КФК-МВ было диагностически значимым, но у 2 пациентов (3%), показатели не достигли пороговых для диагностики значений. Причем, диагноз острого инфаркта был выставлен 27 пациентам (68%) с высоким уровнем КФК-МВ, 2 пациентам (3%) с нормальными значениями данного показателя, и 20 больным (29%) без учета данного критерия (в связи с отсутствием результатов теста). Результаты ДЭХОКГ имелись только у 11 пациентов(15%). Во всех случаях имелись зоны гипокинезии и/или акинезии, однако у всех этих пациентов в анамнезе уже имелся как минимум 1 перенесенный инфаркт миокарда. Диагноз острого инфаркта миокарда был выставлен 65 пациентам, и только у 2 пациентов - острый коронарный синдром. Всего вскрытие производилось в 57 случаях. По результатам патолого-анатомического вскрытия диагноз острого инфаркта миокарда не был подтвержден у 2 пациентов. У первого пациента при направлении на вскрытие был выставлен диагноз острого инфаркта миокарда без локализации, а выявлен первичный рак легкого. У него имелось достоверное повышение уровня КФК-МВ (в 3 пробах из 3 забранных), отсутствовали изменения на ЭКГ, ДЭХОКГ не выполнялась. У второго пациента направительным диагнозом был острый коронарный синдром, а выявлена деструктивная левосторонняя пневмония. У него так же имелось достоверное повышение уровня КФК-МВ, имелись выраженные изменения на ЭКГ, и зоны гипокинезии по результатам ДЭХОКГ. Передняя локализация инфаркта совпадала с результатами аутопсии в 100% случаев, задняя только в 50% (у 4 пациентов (11%) диагноз не подтвердился, а у 14 (37%) - наоборот, нее был диагностирован). Достоверной связи между клинической оценкой и результатами аутопсии поражений перегородочно-верхушечной области, также как и поражений боковой области выявлено не было (соответственно р=0,18 и р=0,5).
Заключение. Реальное использование критериев диагностики острого инфаркта миокарда не всегда совпадает с рекомендованными стандартами. Наиболее легкой является диагностика переднего инфаркта. Наибольшие сложности возникают при локализации зоны поражения в перегородочно-верхушечной и/или боковой области.
Содержание
Необходимо знать, какие симптомы и признаки прогрессирующего инфаркта миокарда существуют, чтобы своевременно оказать пострадавшей стороне первую помощь. Действовать требуется незамедлительно, иначе пациента ожидает скоропостижный летальный исход. Характерные признаки инфаркта миокарда у женщин схожи с другими сердечными заболеваниями, поэтому возникает острая необходимость в дифференциальной диагностике. При болевых симптомах без дополнительной медикаментозной терапии явно не обойтись.
Что такое инфаркт
В идеале, обогащенная кислородом кровь поступает к миокарду по коронарным сосудам, обеспечивая тем самым приемлемое системное кровообращение. Если проходимость сосудистых стенок под воздействием патогенных факторов нарушается, прогрессирует кислородное голодание с дальнейшим формированием очагов некроза на сердечной мышце. С ростом очагов патологии нарушается функция сердца, и этот патологический процесс в современной кардиологии называется инфарктом миокарда. Болезнь имеет выраженную симптоматику, нуждается в своевременной терапии, реанимационных мерах.
Как проявляется инфаркт
Основная цель пациента и врача – избежать ишемического некроза, нормализовать системное кровообращение. В противном случае количество сердечных приступов увеличивается, и пациент может неожиданно умереть. Поэтому обращать внимание требуется уже на первые симптомы при инфаркте, которые меняют даже внешний вид пациента, делая кожу бледной, а взгляд затуманенным. Другие признаки повреждения коронарных сосудов представлены ниже:
давящая боль грудины;
- сниженное артериальное давление;
- спутанность сознания, сопровождаемая головокружением;
- болезненность и тяжесть мышц;
- невнятность речи, неосознанное поведение;
- панические атаки, страх летального исхода;
- затрудненное дыхание при появлении одышки.
Симптомы инфаркта миокарда
Такие болезненные приступы чаще встречаются у представительниц слабого пола в возрасте от 45 лет и старше, однако это вовсе не означает, что мужчинам этот диагноз не свойственный. Патологический процесс сопровождается повышенным артериальным давлением, а завершиться может ишемией миокарда. Врачи выделяют следующие предвестники инфаркта:
- частая одышка при минимальных физических нагрузках;
- сдавленное чувство за грудиной;
- приступы стенокардии;
- повышенное потоотделение;
- острая нехватка кислорода;
- забывчивость, потеря ориентации в пространстве;
- мышечная слабость.

У женщин
Современные женщины старше 45 лет столкнулись с высокой вероятностью инфарктов миокарда на фоне сниженной стрессоустойчивости, тяжелого физического труда. Характерные признаки ишемического некроза в женском организме отличаются от течения болезни у мужчин, а нарушение кровоснабжения сердечной мышцы вызывает не только острый болевой синдром, но и другие признаки заболевания. Это:
- прерывистое дыхание во сне, храп;
- нарушенной водный баланс, который предшествует отеку лица, рук, ступней;
- нарушение сердечного ритма, как при аритмиях;
- учащенное мочеиспускание в ночное время;
- онемение конечностей;
- тошнота, приступы рвоты;
- участившиеся приступы мигрени;
- желудочная боль;
- болезненные ощущения, отдающие в левое плечо.
Характер боли
Это одна из самых опасных сердечных патологий. При обширных инфарктах однозначно присутствует острый болевой синдром, который нарушает дыхание, приковывает к постели, парализует сознание и ограничивает движения. Резкая боль сопровождается не только головокружением, но и бессознательным состоянием, особенно если речь идет о женщинах. Первым делом требуется вызвать скорую помощь, провести ряд реанимационных мероприятий, своевременно преступить к лечению. В противном случае патологический процесс омертвения в тканях миокарда может стоить пациенту жизни.
Ощущения
Приступ острой ишемии начинается с неожиданной боли в сердце, которая отдает в левое плечо, не исчезает после приема обезболивающих средств. На начальной стадии это нерегулярные прострелы, которые при отсутствии терапевтических мер напоминают о себе вновь и вновь. Распознать инфаркт можно по характеру боли, поскольку в стадии рецидива она не отпускает клинического больного.
Признаки миокарда
Симптомы перед инфарктом наталкивают на мысли о прогрессирующем патологическом процессе, возникают за несколько дней – месяц. Чтобы избежать опасных осложнений, реагировать на тревожные признаки требуется незамедлительно, иначе среди последствий – смерть больного. Итак, прогрессирующему некрозу сердечной мышцы и прединфаркту сопутствуют:
- неровное дыхание ночью, храп, одышка;
- боль в левом плече, онемение конечностей;
- систематические приступы аритмии;
- повышенная кровоточивость десен;
- сильная головная боль;
- отечность нижних конечностей;
- участившиеся позывы в туалет.
Пациент при инфаркте ощущает себя в «не своей тарелке», не способен контролировать собственных действий и поступков. Он не чувствует конечностей, невнятно разговаривает, ведет себя неадекватно. Из-за острой боли сердца дыхание затруднено, становится частым, но прерывистым. Пациенту требуется принять горизонтальное положение, а окружающие должны незамедлительно оказать сердечнику неотложную помощь.

Нервные признаки
В патологический процесс вовлечены органы ЦНС, которые дополнены нетипичными симптомами, снижают качество жизни пациента, требуют немедленной госпитализации. После своевременной диагностики можно стабилизировать общее состояние клинического больного, главное – не заниматься поверхностным самолечением. Итак, характерные признаки недуга следующие:
- холодный пот;
- снижение остроты зрения;
- тремор конечностей;
- онемение конечностей;
- приступы мигрени;
- головокружения;
- внутренняя паника и страх;
- навязчивые идеи о смерти;
- хроническая бессонница;
- парестезии верхних конечностей.
Первые признаки инфаркта
Пациент при инфаркте начинает себя плохо чувствовать, а первым признаком характерного недуга становится потеря чувствительности конечностей, онемение языка. Болезненные ощущения отсутствуют, однако изрядно беспокоит давящее чувство в груди. Если пациенту вовремя не оказать квалифицированную помощь, предстоит сражаться с сильными болевыми синдромами, которые напоминают о себе вновь и вновь. При поражениях миокарда острые приступы сопровождаются тошнотой, другие начальные признаки заболевания представлены ниже:
- снижение артериального давления;
- нарушенная фаза сна;
- хроническая усталость;
- нестабильность сердечного ритма;
- частые цефалгии;
- учащенное мочеиспускание в ночное время суток;
- повышенная отечность.
Клиническая картина нетипичных случаев
Если признаки указанного заболевания нестандартные, диагностировать прогрессирующий инфаркт несколько сложнее. Например, с такой проблемой могут столкнуться пациенты с сахарным диабетом, хроническими заболеваниями сердечно-сосудистой и дыхательной системы. Приступ сопровождается невыраженной симптоматикой, поэтому помощь человеку может быть запоздалой. Нетипичные признаки представлены ниже:
- боли в левой стороне корпуса – грудина, плечо, нижняя челюсть;
- болевой синдром подложечной области, с тошнотой, вздутием живота, рвотой;
- нехватка воздуха, астматические приступы;
- признаки острого панкреатита;
- неврологические расстройства.

Диагностика
После перенесенного инфаркта врачи не отрицают присутствие риска повторного рецидива. Такие пациенты-сердечники попадают в группу риска. Поэтому требуется пройти развернутую диагностику с рядом клинических обследований, тестов и лабораторных исследований. В противном случае сложно спрогнозировать клинический исход, исключить смертность. Промедление может стоить жизни пациента, поэтому дифференциальная диагностика должна быть проведена своевременно. Диагностические мероприятия при инфаркте представлены ниже:
- УЗИ сердца обеспечивает объективную оценку затронутой области и степени поражения миокарда при прогрессирующем инфаркте;
- сцинтиграфия, как эффективный метод определить тонкости клинической картины, исключить развитие острого атеросклероза;
- электрокардиограмма для определения этиологии патологического процесса, например, выявляет «засорение» сосудов тромбом;
- лабораторные исследования основных биологических жидкостей для уточнения прогрессирующей клинической картины для конкретного случая.
Видео
Нашли в тексте ошибку?
Выделите её, нажмите Ctrl + Enter и мы всё исправим!
Диагностика инфаркта миокарда базируется на основании трех критериев.
Первый критерий — это наличие болей в грудной клетке ангинозного характера – стенокардия, которая не проходит более чем 15-20 минут. Хотя обычно когда пациента привозят в стационар проходит более 40-60 минут.
Второй критерий — это изменения на электрокардиограмме. Есть типичные признаки инфаркта, но в ряде случаев изменения на ЭКГ можно найти только при тщательном сопоставлении ее с более ранними записями. Некоторые изменения на ЭКГ могут маскировать инфаркт, поэтому только по одной кардиограмме диагноз не устанавливают.
Третий критерий — это маркеры повреждения миокарда. При гибели сердечной клетки, что и происходит при инфаркте, из нее в кровь попадает большое количество некоторых веществ, которые в норме существуют лишь в небольшом количестве, увеличение их концентрации можно обнаружить при анализе крови.
В настоящее время используют два самых достоверных метода это СК-МВ-метод — позволяет уточнить наличие или отсутствие повреждения сердца в течение от 4-6 до 48 часов от начала инфаркта, однако если инфаркт произошел более двух суток назад, то этот анализ будет бесполезен.
Второй метод — это определение такого маркера как Тропонин – этот маркер позволяет обнаружить факт гибели клеток даже по истечению двух недель. При чем в последнее время все больше вошли в обиход тест-полоски, которые вполне достоверно выявляют изменения в крови. Провести этот анализ не сложнее чем экспресс-тест на беременность, только нужна кровь, а не моча.
Наличие всех трех критериев говорит о вероятном инфаркте миокарда, в случае наличия двух — о возможном, при одном — сомнительном.
В последнее время УЗИ сердца тоже вносит большой вклад в диагностику, однако даже в случае выявления зон, подозрительных на инфаркт, определить давность их возникновения не представляется возможным. Это может быть как свежая проблема, так и проблема десятилетней давности.
Инфаркт миокарда и его стадии
Инфаркт миокарда является необратимой гибелью (некрозом) клеток сердечной мышцы, которая развивается из-за острого нарушения коронарного кровоснабжения. Чаще всего причиной этого становится тромбоз одной из артерий, кровоснабжающих сердечную мышцу.
Выделяют отдельные последовательные стадии инфаркта миокарда, каждая из которых характеризуется определенными клиническими проявлениями и требует соответствующего медицинского подхода и лечения.
Стадии развития инфаркта

В клиническом течении типичного инфаркта принято выделять 5 этапов:
- Продромальный (предынфарктный).
- Острейший.
- Острый.
- Подострый.
- Постинфарктный.
Рассмотрим подробнее продолжительность каждой стадии и ее основные характеристики.
Продромальный период
Продолжительность этой стадии инфаркта миокарда составляет от нескольких минут до двух месяцев.
Клиническим признаком этого этапа является прогрессирующая стенокардия с увеличением количества болевых приступов. Болевые ощущения интенсивные, а сами приступы с каждым разом становятся более длительными.
У большей половины пациентов в этот период можно заметить преходящие изменения на ЭКГ и признаки нестабильности миокарда.
Острейший период
У большинства пациентов эта стадия развивается внезапно, в течение нескольких часов. На ЭКГ пациента появляются признаки некроза миокарда.
В этом периоде выделяют различные клинические варианты дальнейшего протекания инфаркта миокарда:
- ангинозный (болевой) вариант. Наступает в 90% случаев. Характеризуется выраженной постоянной жгучей болью в области грудины. Болевые ощущения распространяются в левую руку, лопатку, область шеи, ключицы и нижней челюсти. Это состояние длится в течение получаса и сопровождается резким чувством страха и возбуждения. Не купируется приемом нитроглицерина;
- астматический вариант болезни. Признаки схожи с типичной картиной бронхиальной астмы и сопровождаются усугубляющейся одышкой и затруднением дыхания. Этот вариант чаще встречается у пациентов с тяжелой гипертонической болезнью и при повторных эпизодах инфаркта миокарда;
- абдоминальный вариант. Развивается при расположении некроза в нижних отделах сердечной мышцы. Болевые ощущения возникают в области живота и могут сопровождаться рвотой, тошнотой и диареей. Этот вариант особенно сложен в диагностике, поскольку клиническая картина больше напоминает отравление или другую патологию пищеварительного тракта;
- аритмический вариант. Сопровождается преходящими нарушениями сердечного ритма, блокадами, может протекать с предобморочными состояниями и потерей сознания;
- церебральный вариант болезни. Начинается с признаков нарушения кровоснабжения головного мозга: головная боль, головокружение, расстройство речи, походки, эпилептические припадки и др.
В редких случаях пациент с инфарктом миокарда не предъявляет жалоб и переносит это состояние, даже не подозревая о нарушениях в работе сердца. Признаки такого инфаркта можно после обнаружить на ЭКГ. Такая редкая форма инфаркта встречается у пациентов с сахарным диабетом в анамнезе.
Острый период

Эта стадия длится около 10-12 дней. За это время четко определяются границы некроза сердечной мышцы и начинает формироваться рубец.
Клинически в эту стадию может наблюдаться:
- подъем температуры тела;
- увеличение СОЭ и количества лейкоцитов;
- повышение активности «сердечных» ферментов (креатинфосфокиназы, аспартатаминотрансферазы, тропонина, кардиоспецифичного белка миоглобина);
- типичные изменения ЭКГ (положительная динамика сегмента ST, зубца T и патологический зубец Q).
Подострый период
Эта стадия продолжается до 2 месяцев и завершается формированием соединительнотканного рубца. Состояние пациента практически нормализуется, исчезают или сглаживаются симптомы сердечной недостаточности. У некоторых пациентов по завершении этой стадии могут развиваться перикардит, плеврит, пневмония, лихорадка, боли в суставах и крапивница (синдром Дресслера).
Постинфарктный период
Длится до полугода. В это время сердце приспосабливается к новым условиям работы и происходит консолидация рубца. Поскольку уменьшается количество сокращающихся сердечных клеток, у пациента могут наблюдаться симптомы стенокардии, хронической сердечной недостаточности. Нередко в этот период развивается повторный инфаркт миокарда. На ЭКГ появляются признаки до конца сформировавшегося рубца.
Диагностические критерии
Ключевыми диагностическими параметрами болезни являются:
- типичная клиническая картина (в случаях ангинозного варианта);
- изменения на ЭКГ. Позволяют поставить достоверный диагноз большей части пациентов. Основными признаками инфаркта считаются: появление патологического зубца Q или комплекса QS, смещение сегмента ST и некоторые другие;
- динамика активности ферментов в анализе крови. Изменения ферментов четко соотносятся с конкретными показателями и временем, которое прошло от предполагаемого начала заболевания.
Разновидности и классификация инфаркта
Помимо выделения определенных стадий развития инфаркт классифицируют:
- по объему поражения на мелко- и крупноочаговый;
- по характеру течения: повторный, затяжной, рецидивирующий и моноцикличный;
- по местоположению очага поражения: верхушечный, левого и правого желудочка, инфаркт перегородки и другие;
- по анатомии: трансмуральный, интрамуральный, субэпикардиальный и др.
Осложнения и последствия заболевания

Осложнения инфаркта определяют степень тяжести болезни, осложняют ее течение и нередко становятся причиной летального исхода. Различают осложнения раннего и позднего периода.
Ранние осложнения появляются в несколько первых дней или часов после начала инфаркта. К таким осложнениям относятся:
- кардиогенные шок;
- острая сердечная недостаточность;
- нарушение ритма и проводимости;
- разрыв сердца;
- аневризма сердца;
- тромбоэмболия.
Самое частое ранее осложнение – это изменения сердечного ритма и развитие экстрасистол, блокад и аритмий. Такие процессы существенно усугубляют течение болезни, что в конечном итоге может привести к остановке сердца.
Разрыв сердца развивается очень редко и появляется при тотальном поражении сердечной мышцы. При внешних разрывах болезнь заканчивается летальным исходом у любого пациента.
В позднем периоде может наблюдаться поражение плевры, легких и перикарда. Нередко встречается тугоподвижность и болезненность сустава левого плеча.
У ряда пациентов появляются психические расстройства, особенно у людей пожилого возраста. Они становятся раздражительными, развивается мнительность, истерия и депрессивное состояние.
Подходы к терапии
Лечение болезни проводится по нескольким фронтам:
- устранение боли. Дома в первую очередь принимают нитроглицерин, а в условиях стационара снимают боль нейролептиками и наркотическими анальгетиками;
- ограничение зоны поражения. Для этого необходимо восстановить коронарный кровоток и обеспечить сердце достаточным количеством крови. Используют тромболитические средства, бета-адреноблокаторы и вазодилататоры;
- улучшают кровоток в зоне сужения коронарной артерии;
- лечение сопутствующих симптомов и осложнений;
- психологическое и физическое восстановление пациента.
Инфаркт миокарда – грозная патология, исход которой зависит от своевременной диагностики и проведенной терапии. Следует знать, как распознать болезнь на ранних стадиях и предупредить ее начало путем профилактических мероприятий.
ВАЖНО ЗНАТЬ!
-->
Симптомы и методы лечения инфаркта миокарда
Инфаркт миокарда признан заболеванием, которое представляет огромную угрозу не только здоровью человека, но и его жизни. Конечно, все проблемы с сердечно-сосудистой системой серьезные, однако это заболевание занимает особое место.
- Общая картина заболевания
- Причины заболевания
- Типизация заболевания
- Симптомы приступа
- Первая помощь
- Диагностика
- Лечение
- Восстановление после приступа
- Профилактика заболевания
Общая картина заболевания
Этот недуг является тяжелейшей формой ишемической болезни. Среди женщин он поражает каждую третью, а среди мужчин каждого второго.
Такая острая форма ишемии возникает из-за того, что к какому-либо отделу миокарда прекращает поступать кровь. Этот участок становится мертвым после 15-20 минут бескровного состояния. Из-за чего прекращается доступ крови? Причиной этому служит атеросклеротическая бляшка, которая находится в одном из сосудов сердца. Из-за нагрузки она разрушается, вследствие чего образуется кровяной сгусток, называемый тромбом. Он и перекрывает кровоток, от которого зависит полноценная работа всего сердца. На месте инфаркта возникает рубец, который остается на всю жизнь. Лечение и реабилитация избавиться от него не помогут, хотя могут уменьшить количество других последствий после заболевания.

Сегодня такое сердечное недомогание поражает не только пожилых людей. Все чаще стали проявляться случаи, когда оно вторгалось в жизнь тех, кому совсем недавно стало тридцать лет. Замечено, что до 50 лет инфаркт очень редко застает женщин, так как до этого возраста их сосуды защищают от атеросклероза эстрогены и другие половые гормоны. Как только наступает климакс, ситуация меняется, и этот недуг начинает посещать нашу прекрасную половину даже чаще, чем мужчин. Классификация инфаркта миокарда бывает разных видов, однако степень угрозы от этого не становится меньше.
Статистика говорит о том, что люди, у которых начался приступ, доживают до больницы лишь в половине случаев. Часто это не зависит даже от скорой помощи. Однако это не вся страшная сторона статистики. К сожалению, не все успевают выписаться из больницы, так как умирают там от смертельных осложнений инфаркта миокарда, так что до реабилитации дело может не дойти.
Причины заболевания
Как мы уже упомянули, в часть миокарда перестает поступать кровь из-за бляшек и тромбов. В общей сложности этиологию заболевания можно разделить на следующие виды:
- атеросклероз коронарных артерий, сюда включается обтурация бляшкой и атеротромбоз;
- тромбофилическое состояние, при котором развивается тромбоз, что вызывает поражение миокарда;
- эмболизация коронарных артерий, то есть избирательная закупорка сосудов, которая проводится специально введенными эмболами;
- ятрогенные эклюзии, то есть когда артерия перевязывается или повреждается при ангиопластике.
Кроме того, есть определенные факторы риска заболевания. Это, своего рода, дополнительные причины инфаркта миокарда. Они делятся на более значимые и менее значимые. К первой группе относятся три фактора.
- Большое количество холестерина в крови. В ответ на такое состояние клетки, которые входят в структуру сосудистой стенки, активно размножаются и замуровывают холестерин. Это приводит к образованию фиброзной бляшки, которая пропитывается солями кальция, в результате чего становится плотной, даже твердой. Такая бляшка начинает закрывать просвет сосуда. Также из-за нее стенка сосуда становится плотной и невосприимчивой к расширяющим стимулам. В конце концов, это может привести к тому, что просвет совсем закроется, а кровь перестанет поступать в миокард. Результат – приступ, его последствия и дальнейшая реабилитация.
 Переизбыток холестерина создает бляшки на стенках сосуда
Переизбыток холестерина создает бляшки на стенках сосуда
- Гипертония. Это способствует развитию атеросклероза, что, как мы уже знаем, является причиной ишемии.
- Курение. Курильщики не только травят себя никотином, но чаще всего ведут неправильный образ жизни, из-за чего развивается атеросклероз. Никотин, который содержится в табачном дыме, вызывает спазм сосудов, поэтому уменьшается их просвет. Еще никотин вызывает явления, из-за которых свертывается кровь.
Менее значимых факторов риска больше. Их влияние на развитие инфаркта остается спорным, однако, свою роль они все же оказывают, тем более что из-за них общее состояние здоровья человек находится под угрозой.
- низкая физическая активность.
- сахарный диабет.
- ожирение.
- избыточное жирное питание.
- злоупотребление алкоголем.
- хронический стресс.
Стоит отметить, что дальнейшая реабилитация включает в себя борьбу с этими факторами.
Типизация заболевания
Инфаркт миокарда может сосредотачиваться в разных местах:
- В левом желудочке. Здесь можно выделить инфаркт миокарда передней стенки и инфаркт миокарда задней стенки. Также есть боковой и нижний виды.
- Локализация приступа в верхушке сердца.
- Локализация в межжелудочковой перегородке.
- Сочетанное купирование: передне-боковой и так далее.
- Поражение правого желудочка.
Кроме того, заболевание можно разделить по объему поражения (крупноочаговый и мелкоочаговый), по течению (моноциклическое, затяжное, рецидивирующее, повторное) и по другим признакам.
Симптомы приступа
Чтобы вовремя оказать первую помощь при таком опасном заболевании, нужно хорошо знать, как оно проявляется. Симптомы инфаркта миокарда проявляются следующим образом:
- Боль, очень интенсивная, практически парализующая человека. В основном она возникает за грудиной и распространяется в руку, плечо, шею и челюсть. Она может быть постоянной и перемежающейся.
- Учащенное дыхание.
- Слабость.
- Частое неритмичное сердцебиение.
- Тошнота или рвота.
- Потеря сознания.
- Обильное потоотделение.
- Учащенный пульс.
- Бледность лица.
Независимо от того, происходит инфаркт миокарда правого желудочка или левого, признаки будут в целом одни и те же, но проявляться они могут индивидуально. Важно то, что поражается сердечная мышца – миокард, а это является огромной угрозой для человека, особенно если сразу не начать реабилитацию.
Первая помощь
Самое главное, что нужно запомнить – сразу же вызвать скорую помощь. Однако до ее приезда нужно предпринять ряд действий, которые поспособствуют облегчению больного.
Лучше открыть в помещении окно и уложить пострадавшего так, чтобы была приподнята верхняя часть туловища. Также нужно расстегнуть одежду, которая может стеснять дыхание.

Пока едут врачи, нужно измерить давление и сердечный ритм больного, понаблюдать за его дыханием, дать таблетку нитроглицерина или аспирина. Если прошло около тридцати минут, а боль не проходит и не видно скорой, нужно повторно принять таблетку. При остановке сердца, следует немедленно переходить к реанимационным действиям. Такая неотложная помощь включает в себя непрямой массаж сердца и искусственное дыхание.
В любом случае, скорая уже должна подоспеть. Чтобы это произошло быстрее, при звонке нужно описать все симптомы. Медперсонал доставит пациента в больницу, где он пройдет необходимое лечение и реабилитацию. Будет проведено необходимое обследование, в ходе которого станет ясно, произошел инфаркт миокарда правого желудочка, верхушки сердца или другого места.
Диагностика
Независимо от того, насколько явными являются признаки инфаркта миокарда, проводится дополнительная диагностика заболевания. Картину помогает восстановить ЭКГ. В том случае, если она неясная, делают эхокардиографию, которая помогает выявить скрытую ишемическую болезнь.

Точная диагностика поражения миокарда должна быть проведена вместе с взятием анализов крови. Число лейкоцитов в крови растет в первые и вторые сутки. На третьи сутки их число будет максимальным, после чего начнет уменьшаться, а СОЭ будет нарастать.
Также в крови появляются маркеры, которые помогают поставить диагноз. При инфаркте появляется тропонин – сократительный белок, которого нет в нормальном состоянии. Такое исследование, как рентгенография, проявит застой в легких, который является признаком осложнения.
Данные методы диагностики окажут неоценимую помощь в постановке диагноза и проведении дальнейшей реабилитации.
Лечение
В первые часы, проводимые в больнице, стараются восстановить кровоток. Растворяется новообразованный тромб. Также предотвращается образование новых сгустков. Для этого используют антикоагулянты, которые замедляют свертывание крови. Хорошо помогает обычный аспирин, применение которого уменьшает осложнения в процессе поражения миокарда.

Кроме того, лечение инфаркта миокарда включает в себя применение блокаторов, которые способствуют тому, что миокард нуждается в меньшем количестве кислорода. Благодаря этому уменьшается некроз, а сердце функционирует более экономично.
Последнее время широко применяются немедикаментозные методы лечения, оказывающие неоценимую помощь. Если лекарственная терапия не приносит ощутимого результата, применяют коронарную баллонную ангиопластику, а иногда проводят аортокоронарное шунтирование. Все эти методы нацелены не только на то, чтобы улучшить состояние пациента в данный момент, но и чтобы было как можно меньше последствий такой тяжелой болезни.
Восстановление после приступа
Реабилитация берет свое начало еще в больнице с приема лекарственных средств. При этом проходятся физиотерапевтические процедуры. Постепенно увеличивается интенсивность физических нагрузок. Здесь важно не переусердствовать.
Вначале – лечебная физкультура, потом ходьба по ровной поверхности, а затем по лестницам. Последний вариант является хорошей проверкой на то, насколько человек, который перенес инфаркт миокарда, готов к активной жизни. Если, поднявшись на четвертый этаж, не чувствуется боли или одышки в груди, значит восстановление проходит хорошо.
Профилактика заболевания
Каждому человеку нужно помнить, что его здоровье в большинстве случаев находится в его руках. Настоящей помощью от многих болезней, в том числе от инфаркта миокарда, является образ жизни.
- Активный образ жизни. Нужно больше двигаться, больше ходить пешком! Если это включается в реабилитацию после заболевания, значит, это важно делать до него, так как это может помочь избежать приступа вообще.
- Отказ от курения и чрезмерного употребления алкоголя.
- Снижение лишнего веса.
- Поддержка артериального давления на должном уровне.
ЭКГ - наиболее важное исследование, которое необходимо выполнить в течение 10 мин после приема пациента. ЭКГ - ключевой момент в определении тактики, поскольку введение фибринолитических препаратов приносит пользу больным с STHM, но может увеличивать риск у больных с HSTHM.
В отношении больных с STHM начальная ЭКГ обычно бывает диагностической, поскольку демонстрирует подъем сегмента > 1 мм в двух или более смежных отведениях, отражающих локализацию пораженной области. Патологический зубец не обязателен для постановки диагноза. Электрокардиограмму необходимо читать тщательно, поскольку подъем сегмента может быть небольшим, особенно в нижних отведениях (II, III, aVF). Иногда внимание врача по ошибке сосредоточивается на отведениях, где присутствует снижение сегмента. При наличии характерных симптомов подъем сегмента имеет специфичность 90 % и чувствительность 45 % для диагностики инфаркта миокарда. Последовательный анализ серии данных ЭКГ (выполняют в первый день каждые 8 ч, далее ежедневно) позволяет выявить динамику изменений с постепенным обратным их развитием или появление патологических зубцов, что в течение нескольких дней позволяет подтвердить диагноз.
Поскольку нетрансмуральный инфаркт миокарда происходит обычно в субэндокардиальном или интрамуральном слое, он не сопровождается появлением диагностически значимых зубцов или существенных подъемов сегмента. Обычно такие инфаркты миокарда характеризуются различными изменениями сегмента ST-T, которые менее существенны, переменны или неопределенны и иногда интерпретируются с трудом (HSTHM). Если подобные изменения несколько улучшаются (или ухудшаются) при повторных ЭКГ, ишемия вероятна. Однако, когда данные повторных ЭКГ остаются неизменными, диагноз острого инфаркта миокарда маловероятен, и, если сохраняются клинические данные в пользу инфаркта миокарда, необходимо использование других критериев для постановки диагноза. Нормальная электрокардиограмма, полученная у пациента без боли, не исключает нестабильную стенокардию; нормальная электрокардиограмма, записанная на фоне болевого синдрома, хотя и не исключает стенокардию, свидетельствует о вероятности другой причины боли.
При подозрении на инфаркт миокарда правого желудочка обычно выполняют ЭКГ в 15 отведениях; дополнительные отведения записывают в V 4 R и (для выявления заднего инфаркта миокарда) в V 8 и V 9 .
ЭКГ-диагностика инфаркта миокарда более трудна, если имеется блокада левой ножки пучка Гиса, поскольку данные ЭКГ напоминают изменения, характерные для STHM. Подъем сегмента, конкордантный комплексу QRS, свидетельствует в пользу инфаркта миокарда, как и подъем более 5 мм сегмента по крайней мере в двух грудных отведениях. В целом любой больной с клиническими признаками инфаркта миокарда и появлением блокады левой ножки пучка Гиса (или если не было известно о ее наличии до данного эпизода) получает лечение, как больной с STHM.
ЭКГ при инфаркте миокарда с зубцом Q
Крупноочаговые изменения. По ЭКГ устанавливают диагноз инфаркта миокарда с зубцом Q, определяют стадию инфаркта миокарда и локализацию крупноочаговых изменений.
Патологический зубец Q в большинстве случаев начинает формироваться через 2 ч и полностью сформировывается в пределах 12-24 ч. У части больных патологический зубец Q формируется в течение одного часа после появления симптомов инфаркта миокарда. Патологическим считают зубец Q шириной 0,04 с и более (или 0,03 с, если его глубина более 1/3 зубца R) или комплекс QS. Кроме этого, патологическим считается любой, даже «крошечный» зубец Q (q), если он регистрируется в грудных отведениях V1-V3 или в нижних отведениях (II, III, aVF) - комплексы типа qrS. Американская коллегия кардиологов предложила считать признаком инфаркта зубцы Q шириной 0,03 с и более и глубиной 1 мм и более, а также любые Q в отведениях V1-V3. Появление блокады левой ножки пучка Гиса классифицируют как «неопределенный тип ИМ» (АСС, 2001 г).
Локализация крупноочаговых изменений
Принято различать 4 основных локализации инфаркта: передний, боковой, нижний и задний. Инфаркт миокарда нижней локализации иногда называют задним или заднедиафрагмальным, а задний инфаркт называют также зад-не-базальным или «истинно задним».
Если крупноочаговые изменения ЭКГ регистрируются в отведениях V1-4 - диагностируют передне-перегородочный инфаркт, если в отведениях I, aVL, V5-6 - боковой (если крупноочаговые изменения регистрируются только в отведении aVL - говорят о «высоком боковом инфаркте»), при изменениях в нижних отведениях II, III, aVF - нижний инфаркт. Задний (или задне-базальный) инфаркт миокарда распознают по реципрокным изменениям в отведениях V1-2 - все «перевернуто» («перевернутый ИМ»): вместо Q - увеличение и уширение зубца R, вместо подъема сегмента ST - депрессия сегмента ST, вместо отрицательного зубца Т - положительный зубец Т. Дополнительное значение в выявлении прямых ЭКГ-признаков заднего инфаркта миокарда (зубцов Q) имеет регистрация задних отведений V8-V9 (слева по лопаточной и паравертеб-ральной линиям). В большинстве случаев у больных с инфарктом задней локализации одновременно развивается нижний или боковой инфаркт, нередко с вовлечением правого желудочка. Изолированный задний инфаркт - явление довольно редкое.
Среди перечисленных локализаций инфаркта миокарда труднее всего выявить изменения задней и высокой боковой локализации. Поэтому, при отсутствии явных изменений ЭКГ у больного с подозрением на инфаркт миокарда, необходимо прежде всего исключить наличие признаков инфаркта именно этих локализаций (изменения в отведениях V1-2 или aVL).
У больных с крупноочаговым инфарктом нижней локализации довольно часто (до 50%) имеется также инфаркт правого желудочка, причем у 15% из них гемодинамически значимый ИМ правого желудочка (возникают признаки правожелудочковой недостаточности, гипотония, шок, намного чаще развивается АВ-блокада П-Ш степени). Признаком вовлечения правого желудочка является подъем сегмента ST в отведении VI у больного с нижним инфарктом. Для подтверждения наличия инфаркта правого желудочка надо зарегистрировать ЭКГ в правых грудных отведениях VR4-VR6 - подъем сегмента ST на 1 мм и более является признаком вовлечения правого желудочка. Следует отметить, что подъем сегмента ST в правых грудных отведениях сохраняется недолго - около 10 ч.
Как уже было отмечено, точное определение локализации поражения при ИМ без зубца Q по ЭКГ невозможно, т.к. депрессия сегмента ST или отрицательные зубцы Т не отражают локализации ишемии или мелкоочагового некроза миокарда. Тем не менее принято отмечать локализацию изменений ЭКГ (передне-перегородочная, нижняя или боковая) или просто указывать отведения ЭКГ, в которых регистрируются эти изменения. У 10-20% больных с ИМ без зубца Q в ранней фазе отмечается подъем сегмента ST - в этих случаях можно более-менее точно определить локализацию инфаркта миокарда (после этого обычно наблюдаются депрессия сегмента ST и/или инверсия зубцов Т).
Продолжительность изменений ЭКГ при ИМ без зубца Q может быть любой - от нескольких минут или часов до нескольких недель или месяцев.
Кардиоспецифические маркеры
Кардиоспецифические маркеры - миокардиальные ферменты (например, КФК-МВ) и компоненты клеток (например, тропонин I, тропонин Т, миоглобин), которые выходят в кровь после некроза клетки миокарда. Маркеры появляются в разное время после повреждения, и их количество снижается в различной степени. Обычно исследуют несколько различных маркеров через определенные интервалы времени, чаще каждые 6-8 ч в течение 1 дня. Более новые тесты, выполняемые непосредственно у постели больного, удобнее; они также чувствительны при выполнении с более короткими интервалами (например, в момент поступления больного, а затем через 1,3 и 6 ч).
Критерием для установления диагноза инфаркта миокарда является выявление повышения уровня биохимических маркеров некроза миокарда. Однако повышенные уровни маркеров некроза миокарда начинают определяться только через 4-6 ч от начала инфаркта миокарда и поэтому обычно их определение проводится уже после госпитализации больного. Тем более, что на догоспитальном этапе нет необходимости в выявлении признаков некроза миокарда, т.к. это не оказывает влияния на выбор лечебных мероприятий.
Основным маркером возникновения некроза миокарда является повышение уровня сердечных тропонинов Т («ти») и I («ай»). Повышение уровня тропонинов (и последующая динамика) является наиболее чувствительным и специфичным маркером ИМ (некроза миокарда) при клинических проявлениях, соответствующих наличию острого коронарного синдрома (повышение уровня тропонинов может наблюдаться и при повреждении миокарда «неишемической» этиологии: миокардит, ТЭЛА, сердечная недостаточность, ХПН).
Определение тропонинов позволяет выявить повреждение миокарда примерно у одной трети больных инфарктом миокарда, не имеющих повышения MB КФК. Повышение тропонинов начинается через 6 часов после развития инфаркта миокарда и остается повышенным в течение 7-14 дней.
«Классическим» маркером инфаркта миокарда является повышение активности или увеличение массы изофермента MB КФК («кардиоспецифичный» изофермент креатинфосфокиназы). В норме активность MB КФК составляет не более 3% от общей активности КФК. При инфаркте миокарда отмечается повышение MB КФК более 5% от общей КФК (до 15% и более). Достоверная прижизненная диагностика мелкоочагового инфаркта миокарда стала возможной только после введения в клиническую практику методов определения активности MB КФК.
Менее специфично изменение активности изоферментов ЛДГ: повышение активности преимущественно ЛДГ1, увеличение отношения ЛДГ1/ЛДГ2 (более 1,0). Более раннюю диагностику позволяет осуществить определение изоформ КФК. Максимальное повышение активности или увеличение массы КФК («пик КФК») отмечается в первые сутки инфаркта миокарда, после этого наблюдается снижение и возвращение к исходному уровню.
Определение активности ЛДГ и ее изоферментов показано при позднем поступлении больных (через 24 ч и более). Пик ЛДГ отмечается на 3-4 сутки ИМ. Кроме повышения активности или массы ферментов при инфаркте миокарда отмечается повышение содержания миоглобина. Миоглобин является наиболее ранним (в первые 1-4 ч), но неспецифичным маркером некроза миокарда.
Содержание тропонинов наиболее достоверно для диагностики инфаркта миокарда, но возможно его повышение при ишемии миокарда без инфаркта; высокие цифры (фактические значения зависят от методики определения) рассматривают как диагностические. Пограничные показатели тропонина у больных с прогрессирующей стенокардией указывают на высокий риск неблагоприятных событий в будущем и, таким образом, на необходимость в дальнейшем обследовании и лечении. Ложноположительные результаты иногда получают при сердечной и почечной недостаточности. Активность КФК-МВ - менее специфичный показатель. Ложно-положительные результаты возникают при почечной недостаточности, гипотиреозе и повреждении скелетных мышц. Количество миоглобина - показатель, неспецифичный для инфаркта миокарда, однако, поскольку его содержание увеличивается ранее, чем других маркеров, он может быть ранним диагностическим признаком, способствующим диагностике при нехарактерных изменениях данных ЭКГ.
Эхокардиография
Для выявления зон нарушения регионарной сократимости широко используют эхокардиографию. Кроме выявления участков гипокинезии, акинезии или дискинезии, эхокардиографическим признаком ишемии или инфаркта является отсутствие систолического утолщения стенки левого желудочка (или даже его утоныиение во время систолы). Проведение эхокардиографии позволяет выявить признаки инфаркта миокарда задней стенки, инфаркт миокарда правого желудочка, определить локализацию инфаркта миокарда у больных с блокадой левой ножки. Очень важное значение имеет проведение эхокардиографии в диагностике многих осложнений инфаркта миокарда (разрыв папиллярной мышцы, разрыв межжелудочковой перегородки, аневризма и «псевдоаневризма» левого желудочка, выпот в полости перикарда, выявление тромбов в полостях сердца и оценка риска возникновения тромбоэмболии).], , , ,
Другие исследования
Обычные лабораторные исследования не являются диагностическими, однако способны демонстрировать некоторые отклонения от нормы, которые могут возникать при некрозе ткани (например, увеличение СОЭ, умеренное повышение количества лейкоцитов со сдвигом лейкоцитарной формулы влево).
Визуализирующие методы исследования не нужны для постановки диагноза, если кардиоспецифические маркеры или данные ЭКГ подтверждают диагноз. Однако в отношении больных с инфарктом миокарда прикроватная эхокардиография неоценима как метод, позволяющий выявить нарушения сократительной способности миокарда. Перед выпиской из стационара или вскоре после нее пациентам с признаками ОКС, но отсутствием изменений данных ЭКГ и нормальными кардиоспецифическими маркерами выполняют стресс-тест с визуализацией (радиоизотопное или эхокардиографическое исследование, выполняемое на фоне физической или фармакологической нагрузки). Выявленные изменения у таких пациентов указывают на высокий риск осложнений в следующие 3-6 мес.
Катетеризацию правых камер сердца с использованием пульмонального катетера баллонного типа можно использовать для измерения давления в правых отделах сердца, легочной артерии, давления заклинивания легочной артерии и сердечного выброса. Это исследование обычно выполняют только в том случае, если у больного развиваются тяжелые осложнения (например, тяжелая сердечная недостаточность, гипоксия, артериальная гипотензия).
Коронарографию наиболее часто используют для одновременной диагностики и лечения (например, ангиопластика, стентирование). Однако ее можно применять с диагностической целью у больных с признаками продолжающейся ишемии (по результатам ЭКГ и клинической картине), гемодинамически неустойчивых, с продолжающимися желудочковыми тахиаритмиями и другими состояниями, свидетельствующими о повторении ишемических эпизодов.
Формулировка диагноза инфаркта миокарда
«Инфаркт миокарда с зубцом Q передне-перегородочной локализации (дата начала симптомов инфаркта миокарда); «Инфаркт миокарда без зубца Q (дата начала симптомов)». В первые несколько дней инфаркта миокарда многие кардиологи включают в диагноз определение «острый» (формально острым периодом инфаркта миокарда считается 1 месяц). Конкретные критерии острого и подострого периодов определены только для ЭКГ-признаков неосложненного инфаркта миокарда с зубцом Q. После диагноза инфаркта миокарда указывают осложнения и сопутствующие заболевания.
В первую очередь, следует заметить, что инфаркт миокарда заслуженно считается тяжелейшей патологией сердца, напрямую связанной с разрушением (некрозом) сердечных тканей.
Это экстренное патологическое состояние обуславливается развитием частичной или полной (абсолютной) недостаточности кровоснабжения определенной части мышечной оболочки сердца (миокарда).
Рассматриваемое неотложное состояние ежедневно уносит десятки тысяч жизней по всему миру, некоторым людям, после перенесенной патологии приходится столкнуться с инвалидностью, которая присваивается в связи с возникшими ограничениями трудоспособности. Усложняет диагностику данного экстренного состояния количество форм и разновидностей патологии, ведь различные виды инфаркта симптоматически могут проявлять себя очень по-разному.
Атипичные формы инфаркта миокарда, вернее сказать, их клинические проявления могут носить атипичный характер, когда классическая симптоматика поражения сердца полностью отсутствует или значительно искажается.
Нередко практикующие врачи сталкиваются с ситуациями, когда описываемое экстренное состояние может маскироваться под иные патологии, никак не связанные с работой сердца. Как результат, при диагностировании проблемы тратится огромное количество драгоценного времени, патология прогрессирует, а прогнозы выживаемости ухудшаются.
Чтобы понять, как может себя вести данное неотложное состояние, предлагаем рассмотреть, каким образом, на сегодняшний день, выглядит общепринятая классификация инфаркта миокарда.
- Как классифицируют?
- Относительно места локализации
- Патологии разных типов
- Диагноз субэпикардиальный инфаркт
- Диагноз субэндокардиального инфаркта
- Диагноз трансмурального инфаркта
- Диагноз – интрамуральный инфаркт
- По величине патологического очага
- Первичная, рецидивирующая, повторная формы
- Неосложненная или осложненная патология
- Типичные и атипичные
- Основные периоды
Как классифицируют?
Итак, принятая на сегодня, классификация инфаркта определяет несколько критериев, позволяющих отнести имеющуюся патологию к той или иной классификационной группе.
Основные критерии классифицирования заключаются в следующем:
По топографическому расположению, инфаркт может быть:
- правожелудочковым;
- левожелудочковым (с некротическим поражением боковых, передних задних стенок миокарда, с вовлечением в процесс межжелудочковой перегородки).

Согласно глубине проникновения некротического очага медики выделяют:
- некротические поражения миокарда субэндокардиального типа (с прилежанием очага некроза к внутренним частям мышечной оболочки сердца);
- поражения тканей субэпикардиального типа (очаг некроза прилегает к внешним сторонам миокарда);
- патология трансмурального типа – это, так называемый, сквозной либо проникающий некроз, когда мышечная оболочка сердца поражается на всю ее толщину;
- поражение интрамурального типа (с расположением некротического очага в толще мышечных тканей).

Согласно размерам очагов некротического поражения выделяются:
- Инфаркт миокарда крупноочагового типа;
- Либо же мелкоочаговая патология.
Согласно количеству повторений бывают:
- приступы первичные;
- рецидивирующие состояния, повторяющиеся в течение первых двух месяцев после первого инфаркта;
- повторные приступы, появляющиеся после двух месяцев со дня первичного обнаружения проблемы.
По развитию осложнений некротическое поражение миокарда может быть:

Согласно развивающейся клинической картине выделяют:
- типичную (классическую) форму приступа, когда симптоматика вполне характерна инфаркту мышечной оболочки сердца и легко узнаваема;
- различные атипичные виды, которые могут проявлять себя кардинально по-разному.
Внимание! Самостоятельно распознать ту или иную форму инфаркта невозможно, зачастую, некоторые виды патологии сложно диагностируются даже в условиях специального медицинского учреждения!
Именно поэтому, замечая непонятную вам симптоматику лучше не заниматься самолечением, не терять драгоценного времени, а сразу обращаться за квалифицированной медицинской помощью.
Относительно места локализации
Как мы уже заметили, инфаркт миокарда может быть: с поражением правого/левого желудочка, их боковой, передней либо же задней стенок, а также с некрозом, затрагивающим межжелудочковую перегородку.

Левожелудочковая патология встречается значительно чаще, нежели поражение правой стороны сердца.
Приступ, характеризующийся поражением передних стенок миокарда, принято еще называть передним инфарктом.
Симптоматика некротического поражения передних стенок левого желудочка, чаще всего, классическая, однако ее интенсивность может зависеть от глубины и обширности некротического очага.
Задний инфаркт, характеризующийся расположением очага некроза на задней стенке левого желудочка, также протекает с классическими симптомами – острой болью за грудиной, страхом смерти, тахикардией и пр.
Приступ некротического поражения миокарда, носящий название нижний или базальный инфаркт характеризуется расположением очага некроза на нижней стенке левого желудочка.
Кроме того, медики могут отдельно выделять:

Чаще всего, медики все же используют обобщенные термины: правожелудочковый или левожелудочковый инфаркт миокарда (мышечной оболочки сердца).
Патология, поражающая правый желудочек обнаруживается при развитии специфической симптоматики: гипотензии, трепетании предсердий, чистоте легочных полей, нарушениях ритма, что подтверждается данными ЭКГ.
Инфаркт, поражающий структуры левого желудочка, удается распознать также только после проведения электрокардиограммы, на которой прекрасно видны связи ишемического повреждения с имеющейся клинической картиной.
ЭКГ подтверждением некроза структур левого желудочка могут считаться: элевации сегментов ST, обнаружение патологических зубцов Q.
Патологии разных типов
Здесь нам хотелось бы уделить внимание классификации патологии по глубине проникновения некроза в стенки миокарда. Согласно данной классификации медики выделяют приступы субэндокардиального, субэпикардиального, трансмурального или интрамурального типа.
Диагноз субэпикардиальный инфаркт

Термин может иметь место при расположении некротического очага непосредственно у эндокарда (внутреннего слоя оболочки сердца) левого желудочка, когда поражение имеет вид узкой полоски.
На электрокардиограмме при данной форме инфаркта патологический зубец Q обычно не регистрируется.
Диагноз субэндокардиального инфаркта
Терминология обоснована, когда после острого ангинозного состояния записи кардиограммы регистрируют снижение сегмента ST, причем во всех отведениях.
Обычно при этом также отмечается последующее уменьшение зубца R, наблюдается формирование «коронарного» зубца Т с положительным или отрицательным знаком. Такие изменения в записях кардиограммы могут сохраняться больше недели.
Диагноз трансмурального инфаркта

Термин уместен при развитии тяжелейшего экстренного состояния, характеризующегося проникающим некротическим поражением всей толщи стенки миокарда (мышцы сердца).
Такой инфаркт может быть либо крупноочаговым либо обширным. Мелкими очаги при такой патологии практически не бывают.
Данная патология не может обойтись без последующего рубцевания тканей и развития тяжелого постинфарктного кардиосклероза.
Диагноз – интрамуральный инфаркт
Этот термин подразумевает развитие такой патологии, при которой отирание тканей происходит по всей толще (на всю глубину) миокарда, но без задевания патологическим процессом эндокарда или эпикарда.
Характерный признак такого вида патологии – обнаружение на ЭКГ глубинных зубцов Т с отрицательными показателями.
По величине патологического очага
Согласно данной классификации медики различают: крупноочаговые, мелкоочаговые либо обширные формы инфаркта.

Крупноочаговые варианты некротического поражения миокарда характеризуются образованием большого некротического очага (одного или нескольких), тяжелым течением и ярко выраженной симптоматикой. Прогнозы при таком поражении, как правило, не слишком благоприятны.
Мелкоочаговая форма инфаркта, в тоже время, не может считаться менее опасной. Это также критическое экстренное состояние, при котором очаг некроза может быть умеренным.
Данный вариант патологии протекает практически без осложнений (без отека лёгких, аневризм или разрыва сердца). Опасность данной патологии заключается в возможности довольно быстро трансформироваться в крупноочаговую или обширную форму.
Несомненно наиболее опасным для пациента считается обширный инфаркт, при котором пораженными некрозом оказываются практически все ткани того или иного отдела миокарда.
Первичная, рецидивирующая, повторная формы
Как свидетельствуют названия таких видов некроза сердечной мышцы, экстренное патологическое состояние может быть: возникающим первично, рецидивирующим или повторяющимся.

Говоря о первичной патологии, заметим, что инфаркт такого типа чаще возникает после сильного стресса, чрезмерной физической или эмоциональной нагрузки.
Связывается первичная патология с длительно существующей ишемией тканей. Когда врачи говорят о рецидивирующей форме патологии, подразумевается повторение острого состояния в течение двух месяцев после первичного приступа.
Часто рецидивирующий инфаркт может развиваться при недостаточной эффективности лечения, когда пациент не соблюдает всех предписаний врача.
Повторный инфаркт – это экстренное состояние, которое возникает по прошествии двух месяцев со дня первого приступа, когда первичный некротический очаг уже зарубцевался.
Надо сказать, что каждый последующий приступ всегда протекает более тяжело, нежели предыдущий, заметно ухудшая прогнозы выживаемости в дальнейшем.
Неосложненная или осложненная патология
Как и любое иное заболевание, инфаркт миокарда может протекать самостоятельно, а может осложняться иными недугами. Классическая неосложненная патология заканчивается рубцеванием ранее пораженных тканей, частичным или, в редких случаях, полным восстановлением функций.
Среди осложнений данного экстренного состояния наиболее часто встречаются следующие проблемы:

После развития осложнений первичного экстренного состояния прогнозы выживаемости и восстановления функций всегда негативны. Согласно данным статистики общая смертность от осложнений инфаркта составляет практически тридцать процентов.
Типичные и атипичные
По формированию клинической картины (по симптоматике) медики выделяют классическое (типичное) течение инфаркта и его атипичный вариант.
Классический инфаркт имеет определенную стадийность (конкретные стадии инфаркта миокарда, о которых пойдет речь ниже) и сопровождается вполне характерной, узнаваемой симптоматикой.
Атипичные формы рассматриваемой патологии могут быть следующими:

Основные периоды
Как мы уже заметили, рассматриваемое экстренное состояние, обычно имеет строго определенную стадийность. Медики разделяют состояние поражения сердечных тканей на следующие периода или стадии инфаркта миокарда:

В заключение отметим, инфаркт – патология сложная (хотя и достаточно изученная), имеющая множество форм и подвидов.
Самостоятельно определиться с диагнозом бывает практически невозможно. Именно поэтому, медики настаивают – если вы замечаете симптоматику, сходную с инфарктной, важно, как можно быстрее, обратиться к врачам для первичной диагностики, обнаружения проблемы.
Ведь именно ранее обнаружение патологии может спасти жизнь пациенту!
- У Вас часто возникают неприятные ощущения в области сердца (боль, покалывание, сжимание)?
- Внезапно можете почувствовать слабость и усталость…
- Постоянно ощущается повышенное давление…
- Об одышке после малейшего физического напряжения и нечего говорить…
- И Вы уже давно принимаете кучу лекарств, сидите на диете и следите за весом …
Как выполнить расшифровку данных с ЭКГ при признаках инфаркта миокарда?
Чтобы установить диагноз «инфаркт миокарда», используют специальное оборудование – электрокардиограф (ЭКГ). Методика, по которой устанавливается факт данного недуга, достаточно проста и информативна. Отметим, что в медицине используются и портативные варианты данного оборудования, позволяющие распознавать повреждения сердечной мышцы пациента в домашних условиях для контроля состояния здоровья своих близких даже без привлечения дипломированного специалиста. В лечебных заведениях используют многоканальное электрокардиографическое оборудование, которое само расшифровывает полученные данные.
Особенности кровоснабжения миокарда
В первую очередь, хочется отметить механику кровяного потока. Миокард снабжается кровью из артерий, которые начинаются от расширяющейся начальной части аорты, называемой луковицей. Они наполняются кровью в фазе диастолы, а в другой фазе – систоле – поток крови заканчивается путем прикрытия аортальными клапанами, которые приходят в действие под сокращением самого миокарда.
От левой венечной (коронарной) артерии отходит 2 ветви, которые идут общим стволом до левого предсердия. Их называют передней нисходящей и огибающей ветвью. Данные ветви питают следующие отделы сердца:
- левый желудочек: задние части и переднебоковые;
- левое предсердие;
- от правого желудочка частично переднюю стенку;
- 2/3 части от межжелудочковой перегородки;
- АВ-узел.
Правая коронарная артерия (ПК) берет свое начало оттуда же, откуда и левая. Далее она идет по венечной борозде, проходя ее и огибая правый желудочек (ПЖ), переходит на заднюю сердечную стенку и подпитывает заднюю межжелудочковую борозду.
Кровь, идущая по данной артерии, позволяет функционировать следующим участкам:
- правое предсердие;
- задняя стенка ПЖ;
- часть левого желудочка;
- 1/3 межжелудочковой перегородки (МЖП).
От правой ВА отходят диагональные «магистрали» крови, которые подпитывают части сердца:
- переднюю стенку ЛЖ;
- 2/3 МЖП;
- левое предсердие(ЛП).
В половине случаев от венечной артерии отходит еще одна диагональная ветвь, а в другой половине – срединная.
Есть несколько разновидностей коронарного кровоснабжения:
- В 85 процентах случаев задняя стенка снабжается от правой КА.
- В 7-8% — от левой КА.
- Равномерное снабжение кровью от правой и от левой КА.
При грамотном «чтении» кардиограммы, полученной при инфаркте миокарда, нужно разглядеть все признаки, понимать проходящие в сердце процессы, точно их интерпретировать. Есть два типа признаков инфаркта: прямой и реципрокный.
К прямым признакам относят регистрируемые электродом. Обратные признаки (реципрокные) идут как противоположные прямым признакам, регистрируют некроз обратной сердечной стенки. При анализе электрокардиограммы больного важно знать.что такое патологический зубец Q и патологический подъем сегмента ST.
Зубец Q называют патологическим в следующих условиях:
- Имеется в отведениях V1-V.
- В отведениях грудных V4-V6 на 25 процентов превышает высоту R.
- В I и II на 15% превышает R.
- В III превышение от R составляет 60%.
- Во всех V-отведениях сегмент выше на 1 мм от изолинии, кроме грудного.
- В грудных отведениях 1-3 сегмент превышен на 2,5 мм от изолинии, а в 4-6 отведениях на высоту более 1 мм.
Для предотвращения расширения площади некроза нужна своевременная и постоянная диагностика инфаркта миокарда.
Инфаркт миокарда на ЭКГ: расшифровка
Чтобы расшифровать полученные кардиографом данные, нужно знать определенные нюансы. На записанном листе бумаги отчетливо наблюдаются сегменты с зубцами и без. Они обозначаются латинскими буквами, которые отвечает за снятые данные с одного из отделов сердечной мышцы. Данные зубцы являются ЭКГ показателями, критериями инфаркта миокарда.
- Q – показывает раздражение желудочковых тканей;
- R – верхушки сердечной мышцы;
- S – позволяет анализировать степень раздражения стенок межжелудочковой перегородки. Вектор S направлен обратно вектору R;
- T – «отдых» желудочков сердечной мышцы;
- ST – время (сегмент) «отдыха».
Чтобы снять данные с разных участков сердечной мышцы используют, как правило, 12 электродов. Для регистрации инфаркта значимыми считаются электроды, установленные на левую часть груди (фиксируют к отведениям V1-V6).
При «чтении» полученной диаграммы врачи используют методику вычисления длины между колебаниями. Получив данные, можно сделать анализ ритма биения сердца, при этом зубцы обозначают то, с какой силой сердце сокращается. Для определения нарушений нужно использовать следующий алгоритм:
- Проанализировать данные по ритму и сокращениям сердечной мышцы.
- Провести расчет длины между колебаниями.
- Высчитать электрическую ось сердца.
- Изучить комплекс показаний под значениями Q, R, S.
- Провести анализ ST-сегмента.
Внимание! Если произошел приступ инфаркта миокарда без подъема сегмента ST, то причиной тому могли стать разрывы образованной жировой бляшки в кровеносном сосуде. Это приводит к активному свертыванию крови с образованием тромба.
Признаки инфаркта миокарда на ЭКГ
Инфаркт миокарда имеет проявления в разной степени сложности. Существует 4 типа (стадии) инфаркта миокарда, которые можно проследить на кардиограмме пациента.
Острейшая стадия
Первая стадия может длится до трех суток, являясь острейшей во всем протекании недуга. В начальные этапы первой стадии инфаркта миокарда формируется некроз – поврежденный участок, который может быть двух типов: трансмуральный и интрамуральный инфаркт миокарда. ЭКГ в этот период содержит следующие изменения в показаниях работы сердца:
- Сегмент ST приподнятый, образует выпуклую дугу – элевация.
- Сегмент ST совпадает с положительным зубцом T – монофаза.
- В зависимости от тяжести некроза зубец R будет уменьшаться в высоте.
А реципрокные изменения, соответственно, заключаются в увеличении зубца R.
Острая стадия
После этого идет вторая стадия, способная продлиться 2-3 недели. Происходит уменьшение очага некроза. В этом время проявляются ЭКГ-признаки инфаркта миокарда и ишемии вследствие погибших кардиомиоцитов в острый период инфаркта миокарда. На ЭКГ в острый период отмечаются следующие показания электронных датчиков:
- Сегмент ST приближен к изолинии в сравнении с данными, полученными на первой стадии, но он все еще находится выше нее.
- Формируются патологии QS и QR при транс- и нетрансмуральных повреждениях сердечной мышцы, соответственно.
- Формируется отрицательный симметричный зубец T.
Реципрокные изменения противоположны: зубец T увеличивается в высоту, а ST сегмент поднимается к изолинии.
Подострая стадия инфаркта миокарда
Длительность третьей по последовательности стадии еще больше – до 7-8 недель. В это время болезнь начинает стабилизироваться, некроз наблюдается в истинных размерах. В данном периоде показания инфаркта на ЭКГ следующие:
- Сегмент ST выравнивается с изолинией.
- Патологии QR и QS сохраняются.
- Зубец T начинает углубляться.
Рубцевание
Последний этап протекания инфаркта миокарда, начинающийся с 5 недели. Подобное название этап получил из-за того, что на месте некроза начинает образовываться рубец. Данный рубцующийся участок не имеет электрической и физиологической активности. Признаки рубцевания отображаются на ЭКГ следующими признаками:
- Патологический зубец Q в наличии. Стоит помнить, что при транс- и нетрансмуральных недугах наблюдаются патологии комплексов QS и QR, соответственно.
- Сегмент ST выровнен с изолинией.
- Зубец T является положительным, сниженным или выровненным (сглаженным).
В этот период патологические зубцы могут полностью исчезнуть и по ЭКГ нельзя будет выявить произошедший инфаркт.
Как распознать точное место некроза
Чтобы выявить локализацию некроза (инфаркта миокарда) на ЭКГ, необязательно проводить дополнительные обследования. Кардиограмма при инфаркте сможет обеспечить достаточную информацию, чтобы выявить предполагаемую область. При этом кардиограмма сердца будет слегка отличаться.
Еще на показания электрообрудования влияют следующие факторы:
- время начала заболевания;
- глубина поражения;
- обратимость некроза;
- локализация инфаркта миокарда;
- сопутствующие нарушения.
Классифицируя инфаркт по локализации, можно выделить следующие возможные случаи протекания болезни:
- инфаркт передней стенки;
- задней стенки;
- перегородочный;
- боковой;
- базальный.
Определение и классификация зоны поражения помогает оценить сложность и выявить осложнения болезни. Например, если поражение затронуло верхнюю часть сердечной мышцы, то оно не будет распространяться, так как она изолирована. Поражение правого желудочка встречается очень редко к тому же имеет свои особенности при лечении.
К примеру, переднеперегородочный инфаркт на ЭКГ выглядит следующим образом:
- Остроконечные зубцы T в 3-4 отведениях.
- Q – 1-3.
- Сегмент ST имеет подъем в 1-3 сегменте.
Классификация инфаркта миокарда по ВОЗ
Чтобы классифицировать инфаркт миокарда, используют классификацию ВОЗ. Отличает эти нормы то, что применяются они только для классификации крупноочаговых повреждений, потому по этим нормам легкие формы протекания болезни не рассматриваются.
По данной классификации выделяются следующие типы повреждения:
- Спонтанный. Происходит из-за разрушения холестериновой бляшки, эрозии тканей.
- Вторичный. Кислородная недостаточность, вызванная перекрытием кровеносного сосуда тромбом или спазмом.
- Внезапная коронарная смерть. При данном инфаркте происходит полное нарушение сократительной способности сердца с его остановкой.
- Чрескожное коронарное вмешательство. Причиной становится хирургическое вмешательство, приводящее к повреждениям сосудов или сердечной мышцы.
- Тромбоз стента.
- Осложнение шунтирования аорты.
Используя данную квалификацию, можно определить степень некроза и породившие его причины. Как правило, применяется для сложных форм инфаркта, так как легкие можно определить по срокам поражения и локализации.
Классификация по сроку
Чтобы выявить сложность поражения, необходимо правильно установить сроки протекания болезни. Как правило, первично определяют это из анамнеза пациента, который содержит карта вызова, и после проведения начального обследования. Но они позволяют лишь оказать первую помощь и выполнить процедуры до полного выявления диагноза.
Этапы инфаркта по сроку:
- Продромальный. Предынфарктное состояние, когда начинают проявляться симптомы. Длительность может достигать до месяца.
- Острейший. В данном периоде протекает болезнь с образованием некроза. Длительность около 2 часов.
- Острый. Происходит развитие некроза в течение 10 дней, которое может протекать с полным омертвлением некоторых участков.
- Подострый. До пятой недели от начала развития болезни. В данном этапе протекания болезни некрозные участки начинают рубцеваться.
- Послеинфарктный период протекает с адаптацией сердечных мышц к новым условиям функционирования и с полным формированием рубца. Может продлиться до полугода.
После того как реабилитационный период пройден, изменения на ЭКГ исчезают, остаются признаки хронической ишемии.
Внимание! Данная классификация инфаркта по срокам позволяет врачам установить начало развития болезни и выбрать правильное лечение для пациента.
Для успешного лечения инфаркта миокарда важно определение сложности и времени начала инфаркта миокарда. ЭКГ используют для наблюдения активности отдельных участков сердечной мышцы с помощью системы электродов.
На видео показана обучающая анимация по тому, как определить инфаркт миокарда: «ЭКГ под силу каждому»