«Белками теплового шока» (сокр. БТШ или HSP от англ. Heat shock proteins) называются особые соединения, которые клетки живых организмов продуцируют при резком повышении температуры или в результате других стрессовых нагрузок. Первые HSP впервые были обнаружены учеными еще в середине прошлого века. С тех пор роль белков теплового шока в организме растений, животных и человека активно изучалась.
Вначале считалось, что они выполняют исключительно защитную роль, предупреждая возникновение необратимых нарушений. Однако со временем выяснилось, что эти соединения могут принимать активное участие в регенерации поврежденных структур клетки, а также в работе иммунной системы.
В том числе, была выдвинута гипотеза, что HSP участвуют в связывании белковых фрагментов, появляющихся при разрушении клеток злокачественных опухолей. При этом образуются конгломераты, распознаваемые противораковым иммунитетом в качестве «агрессора», т.е. происходит так называемая «презентация антигена». Другими словами, иммунная система человека получает возможность «видеть рак», который в обычных условиях может достаточно успешно от нее маскироваться. В результате запускается естественный процесс уничтожения опухоли.
Подтверждение этой теории, а также доскональное изучение структуры белка теплового шока и его действия в опухолевых тканях на молекулярном уровне, стало возможным только после того, как это уникальное вещество попало на международную космическую станцию. Отправили его в космос российские специалисты НИИ Особо Чистых Биопрепаратов ФМБА, синтезировавшие БТШ с помощью эксклюзивных технологий генной инженерии.

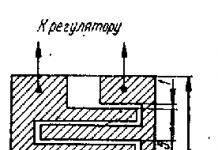
Благодаря невесомости, из исходного материала, «упакованного» в тончайшие молекулярные трубочки, выросли идеально ровные кристаллы белка, пригодные для рентгеноструктурного анализа. Космический этап позволил успешно решить главную проблему, стоявшую перед учеными: в условиях земного притяжения белки росли неравномерно, и получить кристаллы с правильной геометрией на Земле было невозможно. Анализ выращенных в космосе кристаллических белков был проведен российскими и японскими учеными на современном сверхмощном оборудовании.

Полученные данные легли в основу создания уникального препарата, действие которого опробовали сначала в пробирках на клеточных культурах, а потом – на лабораторных животных. Лекарством на основе синтезированного БТШ были пролечены мыши с саркомой и меланомой, включая животных с четвертой (терминальной) стадией заболеваний.
Результаты оказались более чем впечатляющими:
- абсолютное большинство мышей полностью выздоровело;
- не было зарегистрировано ни одного побочного эффекта.
Как российские ученые получают белок теплового шока
HSP продуцируется клетками бактерий, в которые внедрен выделенный из клеток человека и клонированный ген. Этот ген отвечает за синтез белка теплового шока. В настоящее время его изготовление по данной технологии ведется на производственных участках НИИ ОЧБ.

Как «работает» лекарство, и какие виды рака можно будет лечить с его помощью
Применение биопрепарата направлено на повышение концентрации БТШ в опухолевых тканях онкобольных до значений, вызывающих терапевтический эффект. Такая потребность существует потому, что «показывающий рак иммунитету» белок теплового шока в организме человека:
- вырабатывается в очень небольших количествах;
- не может быть «собран» в здоровых клетках и «перенесен» в атипичные клетки раковой опухоли.
Разработчики утверждают, что разработанный ими метод универсален так же, как универсален сам белок, продуцируемый всеми тканями нашего организма. Поэтому если при дальнейших испытаниях лечебное действие лекарства подтвердится, а побочные не будут выявлены, его можно будет применять для терапии абсолютно всех форм рака.
Другие достоинства российской разработки:
- Лечение эффективно на терминальных стадиях, т.е. именно тогда, когда справится с опухолью каким-либо другим способом чрезвычайно сложно, очень часто – невозможно.
- Ученые рассматривают возможность целенаправленного действия препарата. До настоящего времени лекарство вводилось лабораторным животным внутривенно и распространялось с кровью по всему организму. На этапе клинических испытаний специалисты планируют параллельно с внутривенным введением опробовать методику адресной доставки белка теплового шока в клетки опухоли, рассчитывая еще более увеличить эффективность лечения и снизить риск побочных эффектов. Эта возможность принципиально отличает российскую технологию от метода «клеточной терапии CAR-T» , официальное внедрение которого в клиническую практику ожидается уже летом 2017 года.
Деньги на заключительный этап доклинических исследований нового средства (порядка 100 млн. рублей) уже найдены. Остается найти спонсора, который разделит с государством финансирование клинических испытаний. Пока приоритеты отдаются российскому бизнесу. Если же российских спонсоров найти не удастся, будут рассматриваться варианты партнерства с японскими предпринимателями или бизнес-структурами из других стран. На завершение процесса испытаний может понадобиться еще 3-4 года. При их положительном исходе онкологи смогут получить высокоэффективный инструмент в борьбе с раком.
Что может сдерживать инвесторов и снижать уровень оптимизма при прогнозах
Вложения в любые клинические испытания несут достаточно большие риски для бизнеса. Ведь даже при современном развитии науки нельзя со стопроцентной вероятностью предположить, как поведет себя новое лекарство, насколько эффективным и безопасным оно окажется не в пробирке и в организме лабораторной мыши, а на практике. Тем не менее, поиски инвестиций – всего лишь вопрос времени.
Насколько действенным будет новый метод, также покажет время. Например, нельзя исключить, что при ослабленном естественном иммунитете его возможностей для борьбы с опухолью может просто не хватить.
И, разумеется, только по истечении нескольких лет можно будет понять:
- смогут ли раковые клетки мутировать в поисках защиты от «ударных доз» БТШ;
- не вызовет ли действие препарата нежелательных последствий в отдаленном периоде.
Материал с весьма оптимистичным подзаголовком «Генно-инженерный препарат от всех видов и стадий злокачественных опухолей пациенты могут получить через три-четыре года».
Однако любой человек, хоть сколько-нибудь знающий о терапии онкологических заболеваний, при виде такого прогноза в лучшем случае удивленно поднимет брови, а в худшем — возмутится. Рассказываем, что не так с очередной «научной сенсацией».
Что случилось?
Разработка препарата, о котором рассказали в «Известиях», ведется в Государственном научно-исследовательском институте особо чистых препаратов Федерального медико-биологического агентства (ФМБА) России. Замдиректора по научной работе института, член-корреспондент РАН и доктор медицинских наук, профессор Андрей Симбирцев, в этом материале под заголовком «В России создали лекарство от рака и проверили его в космосе» рассказал корреспонденту «Известий» о «белке теплового шока», который был кристаллизован в невесомости, на МКС, и теперь проходит доклинические испытания.
Сейчас исследования проводятся на грант Министерства образования и науки, а 100 миллионов рублей на клинические испытания ученые планируют найти с помощью частных инвесторов и программы государственного 50%-ного софинансирования. Чтобы его привлечь, разработчики собираются «стучаться во все двери, потому что препарат уникальный. Мы стоим на пороге открытия совершенно нового средства лечения рака. Оно позволит помочь людям с неизлечимыми опухолями».
«Мы уже изготавливаем препарат на производственных участках НИИ», — сообщает воодушевленным журналистам Андрей Симбирцев, добавляя, что в данный момент проходят испытания на мышах, а до пациентов он дойдет всего через три-четыре года.
В чем подвох?
Все это звучит очень вдохновляюще, однако белки теплового шока действительно известны давно, но люди почему-то до сих пор не сделали из них панацею от всех видов рака. Это довольно большое семейство белков, которые активируются в ответ на стресс при повышении (а иногда и при понижении) температуры. Они помогают клетке бороться с последствиями деградации структуры других белков. Самый известный пример такого изменения — сворачивание главного компонента яичного белка, альбумина, при жарке или варке, когда он из прозрачного становится белым. Так вот, белки теплового шока устраняют последствия этих изменений: «чинят» или окончательно утилизируют деградировавшие структуры. Многие белки теплового шока являются в то же время шаперонами, которые помогают другим белкам «сворачиваться» правильно.
Справка:
Шапероны — класс белков, основной функцией которых является восстановление третичной или четвертичной структуры белков, также они участвуют в образовании и диссоциации белковых комплексов.
Белки теплового шока есть во всех клетках. Однако в разных клетках (особенно опухолевых, которые сильно отличаются при разных видах рака как друг от друга, так и от нормальных клеток организма) эти белки ведут себя по-разному. К примеру, в одних видах рака экспрессия белка HSP-70 может быть как повышенной (при злокачественной меланоме), так и пониженной (при раке почки).
Чтобы понять, о каком белке идет речь и действительно ли он используется в терапии рака и может помочь при всех его видах, мы поговорили с доктором биологических наук Александром Сапожниковым . Этот ученый — руководитель лаборатории клеточных взаимодействий Института биоорганической химии имени М.М. Шемякина и Ю.А. Овчинникова РАН, которая занимается одним из самых перспективных для разработок в этом направлении белков теплового шока уже много лет. Он так прокомментировал эту статью:
«Я не скажу, что это бред, но это абсолютно некорректная информация. Автором идеи применения белков теплового шока с молекулярной массой 70 килодальтон (так называемые БТШ-70, по-английски HSP70) является мой друг и коллега Борис Маргулис. Он работает в Институте цитологии в Санкт-Петербурге.
Он и его жена Ирина Гужова занимаются этим белком всю жизнь (я тоже занимаюсь им много лет, но не исследованиями, связанными с терапией рака). Формально заведующей лабораторией является Ирина, она занимается изучением того, как белок связан с нейродегенеративными заболеваниями, а Борис — заведующий отделом. Он первый в мире человек, который предложил применять «голый», не нагруженный никакими опухолево-ассоциируемыми антигенами, белок.
Я не верил в его представления о таком применении этого белка (собственно, пока и не доказано, что это будет эффективно). Если «плясать от печки», есть некий индус, Прамод Сривастава , который в Индии родился, но учился, живет и работает в Америке. Он давным-давно сделал не просто «вакцину» против опухоли с помощью БТШ-70, но и открыл клинику и лечит ею онкологических больных. Сривастава выделяет этот белок прямо из опухоли: берет биопсию у пациентов, выделяет его из кусочков ткани (есть специальные способы получить очень высокую фракцию этого белка).
Однако белок, который получают из тканей онкологических больных, находится в прочной связи с опухоль-ассоциированными пептидами — теми признаками опухоли, которые распознает иммунная система. Поэтому, когда этот комплекс вводят больным, у большого количества больных вырабатывается иммунный ответ, и получается позитивный эффект для больного.
На самом деле, по статистике, этот эффект не превышает эффект от применения химиотерапии. Но все-таки химиотерапия «травит» организм, а вот такая «вакцинация» организм не «травит». Это очень давняя история, такой подход давным-давно применяется в клинике.
Александр Сапожников. Доктор биологических наук, профессор
Что касается Бориса Маргулиса, он (в частности, на базе моей лаборатории) показал (и опубликовал результаты своей работы), что если чистый белок, без всякой опухолевой нагрузки, добавить к опухолевым клеткам, то этот экзогенный белок заставляет опухолевые клетки выставлять на свою поверхность те самые опухолево-ассоциированные пептиды, которые в нормальном состоянии находятся внутри этих клеток, в цитоплазме. Тогда иммунная система их распознает, и организм будет своими силами отторгать эти клетки, бороться с опухолью.
Это было показано в культуре in vitro , то есть не в организме, а в пробирке. К тому же Борис Маргулис претендовал только на детские лейкемии, поскольку он связан с клиницистами в Питере. То, что Симбирцев в своем интервью сказал, — это уже расширение вот такого метода применения голого, чистого белка.
Механизм действия этого чистого белка — заставлять опухоль вытаскивать на поверхность (как сам Маргулис это назвал, «выдавливать») эти пептиды со своим эндогенным белком. Этот белок есть во всех клетках, и в мире нет ни единой клетки, у которой не было бы этого белка. Это очень древний, очень консервативный протеин, он есть у всех (о вирусах я не веду сейчас речи).
Сам Маргулис не потянул бы доклинические исследования, он получил (лет пять назад) грант совместно с Институтом особо чистых препаратов. В этом институте, видимо, и работает этот Симбирцев, его фамилию я слышал много раз, но коль скоро это Федеральное медико-биологическое агентство, к которому относится Институт иммунологии на Каширке, в котором я много лет работал, то, скорее всего, это Институт особо чистых препаратов, с которым он получил грант на доклинические исследования. В советские годы это было Третье управление Минздрава. Именно с этим институтом был получен грант на доклинику от Минобра на 30 миллионов на три года, который закончился два года назад.
Все бумажные дела Институт особо чистых препаратов сделал, они отчитались по своему гранту, что касается следующей стадии, продвижения препарата, там тоже нужны деньги. Это первая стадия клинических исследований. Тут Борис Маргулис, насколько я понимаю, уже отошел от разработок, отдав это на откуп Институту особо чистых препаратов.
Они делают этот белок, сделали биотехнологию, у меня он даже в холодильнике есть, Борис давал его для испытаний. Они в больших количествах его делают, хранят в лиофилизированной форме (в сухом виде), в стерильных ампулах. Собственно, этот препарат и надо, может быть с какими-то добавками, применять в клинических испытаниях. Но для этого нужны деньги.
Увидев случайно новость с интервью Симбирцева, я прочитал, послал Маргулису, спросил, читал ли он. Борис мне ответил, что Андрей (с которым он хорошо знаком) сделал какую-то глупость, даже не сослался на авторов. Автором этой идеи (применять чистый белок как противоопухолевый препарат в онкологии), повторюсь, является Борис Маргулис. Но, насколько я от него слышал в последнее время, он от этой проблематики отошел.
Я занимаюсь этим белком, но как иммуномодулятором, как и моя лаборатория. Мы немножко работали с противоопухолевыми свойствами, на мышиных моделях. Там действительно получились хорошие результаты. Я имею в виду «голый» белок, он просто обладает иммуностимулирующими свойствами. Кстати, еще большой вопрос, что является причиной его иммуностимулирующих свойств: сам белок или какие-то маленькие примеси, например липополисахариды. Этот белок получают в бактериальной культуре (в E.coli ), это самая распространенная техника получения рекомбинантных белков. Липополисахариды (ЛПС) — компонент клеточной стенки бактерий, и очистить культуру от этой примеси до конца очень сложно. Конечно, очищают, но какие-то мизерные концентрации остаются. Эти примеси ЛПС тоже обладают иммуностимулирующими свойствами просто потому, что иммунная система в процессе эволюции выработала свою защиту от бактерий. Как только «запах» бактерий появляется в организме, иммунная система активируется. Поэтому многие авторы сейчас считают, что иммуностимулирующие свойства этого белка, которые модулируют и противоопухолевый ответ, вызваны не БТШ как таковым, а его примесью. Но этот вопрос научный, дискуссионный и не имеет отношения к практике.
Сейчас, повторюсь, Борис Маргулис отходит от этой темы, от онкологии, и работает над малыми молекулами, которые способны регулировать продукцию этого белка. Он связался с химиками, которые умеют делать ингибиторы — такие специфические киназы, какие-то ферменты внутри клеток, которые прекращают их работу. Ингибиторы могут сказать какому-то ферменту: «Нет, ты не имеешь права работать».
Это делается очень просто: все ферменты имеют центр связывания с субстратом, и, если взять какую-то маленькую молекулу, которая встроится в этот центр связывания субстрата, он уже не сможет этот субстрат обрабатывать. Борис сейчас как раз занимается такими молекулами, которые ингибируют внутриклеточный синтез этого БТШ-70. И, действительно, такие молекулы очень актуальны, и не только для фундаментальной биологии, но и для практики, клинической медицины».
Александр Сапожников не согласен с таким теоретическим обоснованием механизма действия лекарства. По его словам, HSP70 может работать по другой схеме, которую только предстоит изучить, однако факт остается фактом - на клеточных культурах и ряде опухолей в двух линиях крыс, которым были привиты «человеческие» опухолевые клетки, белок действительно показывает активность.
По словам авторов работы, температура, при которой работают с HSP70 на культурах клеток, составляет 43°C, и она слишком высока для живых организмов, однако там, судя по всему, включаются иные механизмы, которые также только предстоит понять. Это касается и действия экзогенного неклеточного белка теплового шока внутри организма. «У каждого из нас в кровотоке присутствует достаточно высокий уровень HSP70 - до 900 нанограммов на миллилитр. Мы вводили его в животное и пытались смотреть, что с белком происходит дальше. В течение 40 минут мы видели следы HSP70 в крови, а потом он пропал. Есть мнение, что белок распадается, но мы так не думаем».
Впечатляющие результаты в ожидании проверки
Ирина Гужова рассказала и о дальнейших испытаниях препарата: «Мы испытывали этот механизм на мышиной меланоме B16, которая растет подкожно, и использовали в виде геля, наносимого на поверхность кожи. Результат получился впечатляющий: выживаемость мышей была гораздо выше, чем у контрольной группы, которую лечили гелем без действующего вещества или не лечили вообще. Разница была примерно в десять дней. Для мышей и данного типа опухоли это очень хорошая отсрочка. Подобные результаты были показаны и на крысиной глиоме C6 (это опухоль, которая растет непосредственно в мозге).
Животные, которых лечили однократной инъекцией в мозг, получали дополнительно десять дней жизни, а животные, которым вводили белок постоянно в течение трех дней с помощью помпы, эта продолжительность увеличивалась еще на десять дней, так как опухоль росла медленнее. Мы показали, что если обеднить популяцию Т-лимфоцитов от мыши, которая имела опухоль, и убрать уже «наученные» NK-клетки или CD8-положительные лимфоциты, то они не будут узнавать опухоль так хорошо. Можно сделать вывод, что основная функция HSP70 в этом процессе - активация специфического иммунитета».
Эти данные побудили ученых провести ограниченное исследование в рамках клиники имени Поленова (НИИ Нейрохирургии в Санкт-Петербурге). «В это время в нашем коллективе был нейрохирург Максим Шевцов, который одновременно с аспирантурой Бориса Александровича (Маргулиса, - прим. сайт) проходил ординатуру в этом НИИ. Он убедил своего руководителя, профессора Хачатуряна, испытать этот препарат. По тогдашнему законодательству достаточно было решения ученого совета и информированного согласия пациентов, и нам было выделено 25 больных. У них у всех были различные опухоли мозга, и они все получали то, что им полагалось по страховке, но плюс после хирургического удаления опухоли Максим вводил в операционное ложе раствор HSP70.
Проблема в том, что опухоли мозга удалить полностью сложно. Всегда остаются маленькие кусочки, которые опасно удалять, потому что вместе с ними можно удалить личность, и эти кусочки дают рецидивы. Но результаты оказались совершенно потрясающими: после операции у больных увеличивалось количество клеток специфического иммунитета, понижалось количество проопухолевых («перешедших на сторону опухоли») Т-лимфоцитов и уменьшалось количество интерлейкина-10 (информационной молекулы иммунной системы).
Исследование было только пилотное, не рандомизированное, группы контроля тоже не было, и проводилось оно в 2011 году. В том же году был принят закон, согласно которому такие испытания запрещены, и их пришлось прекратить, едва начав. У нас осталось 12 прооперированных пациентов. Кто знаком с клинической частью исследований, тот имеет представление о том, насколько сложно отследить судьбы пациентов после того, как каждый из них покидает клинику. Поэтому мы знаем только о восьми, которые остались доступны для контакта, и все они живы до сих пор. На начало осени прошлого года они были вполне здоровы, и те, кто продолжал учиться, осенью пошли в школу, хотя средний прогноз продолжительности жизни с обнаруженной глиомой - 14 месяцев».
Сейчас, по словам докладчиков, доклинические испытания подходят к концу, и препарату необходима многоступенчатая проверка на пациентах, которая займет несколько лет (вот почему в статье «Известий» фигурировал такой неправдоподобно короткий срок до выхода препарата на рынок - 3-4 года).
Александр Сапожников также подчеркнул важность клинических испытаний: «Привитая мышам опухоль и человеческая - это небо и земля. Препарат может работать на этой опухоли, но быть неэффективным ни на обычной опухоли мыши, ни на человеческой. Успокойте своих коллег, лекарства от всех болезней сразу не бывает».
Так считают и сами исследователи. «На данных стадиях все работает (и очень хорошо), но, конечно же, это не то лекарство, которое поднимает Лазаря, - заявляет Ирина Гужова, - однако оно достаточно эффективно и достойно того, чтобы пройти клинические испытания. И мы надеемся, что это случится».
Просто космос
У читателя может возникнуть резонный вопрос: откуда вообще взялся космос? Ирина Гужова поясняет: «Дело в том, что испытания проходили на базе Института особо чистых препаратов, у сотрудников которого хороший опыт в регистрации патентов и написании бумаг, поэтому мы это дело отдали им. Одновременно они начали производство этого белка, а мы делали опыты на животных. Но в процессе к ним обратился представитель Роскосмоса и спросил, а нет ли у нас какого-то незакристаллизованного белка, чтобы закристаллизовать в космосе, на орбите. И им отдали HSP70, кристаллы пытались вырастить на орбите, но ничего не получилось».
Проблема оказалась в строении белка. Очень подвижная часть в структуре белка мешала кристаллизации, поэтому его стали пытаться закристаллизовать по кусочкам, связывать подвижную часть специальной молекулой, чтобы она его «держала». Пытаются до сих пор. «Отсюда выросла эта история про клетки, которые растут в космосе и лечат всех от рака», - комментирует Ирина Гужова.
Она также сообщила, что для испытаний в космосе и на мышах белок подвергли очень высокой степени очистки - около 99%. Что касается сомнений, что активирует иммунитет не шаперон, а липополисахарид (ЛПС) - компонент клеточной стенки бактерий, в которых нарабатывают этот белок, - такая вероятность невелика. Хотя ЛПС «прилипает» к HSP очень сильно, и очистить от самых мизерных его примесей белок довольно трудно. Ученые ставят дополнительные контроли, чтобы показать, что не он, а именно шаперон - причина эффекта препарата. Например, препарат могут кипятить, что не влияет на ЛПС, но разрушает структуру белка. Тогда его свойства HSP теряются, и препарат перестает работать, чего бы не произошло, если бы в нем действовал в основном бактериальный ЛПС.
Кроме того, исследователи сравнивали эффект введения компонентов клеточной стенки бактерий с эффектом от HSP70, и эти сравнения явно были в пользу последнего.
«Не говорили глупостей. И чего? – Ноль эмоций!»
Ирина сообщает, что побочных реакций в ходе испытаний ученые пока не обнаружили, но они могут быть отсроченными. «Я считаю, что исследователь в первую очередь должен на себе все попробовать сам, и прошла два курса шаперонотерапии. Никаких побочных эффектов не было, наоборот, казалось, что проходят мелкие болячки и крылья вырастают за спиной».
«С другой стороны, все, что было в СМИ, - настоящее безобразие, - отмечает исследователь. - Но, как говорится, не было бы счастья, да несчастье помогло: уже сейчас в Институт особо чистых препаратов поступают звонки с предложениями помочь с клиническими испытаниями. Мы выступали на конференциях и в разных более скромных СМИ, говорили о том же самом, но выверяли слова, не говорили глупостей. И чего? - Ноль эмоций! А тут пронеслась такая вот муть по экранам, и пожалуйста! Такое интересное общество, такая интересная страна».
Впрочем, согласно источникам сайт, интервью, с которого все началось, Симбирцев дал вынужденно. предложили дать интервью, чтобы стимулировать интерес к проблемам Института и привлечь дополнительное финансирование на клинические испытания. Кроме того, ходят слухи о возможной утрате институтом юридического лица вследствие происходящих по всей стране слияний научных организаций. Видимо, ученый оказался не готов подробно и популярно рассказать газете о происходящем. «В этот раз все, что могло быть понято неправильно, было понято неправильно», - замечает источник.
В результате ситуация все больше становится похожа на небезызвестную басню, когда Роскосмос и госструктуры, раздающие гранты, рвутся в облака, ожидая немедленных результатов от фундаментальной науки, рак пятится назад, журналисты разливают структурированную воду… А российская наука в очередной раз оказывается в незавидном положении, вынужденная оправдываться за преступления, которых не совершала.
Генно-инженерный препарат от всех видов и стадий злокачественных опухолей пациенты могут получить через три-четыре года
В Государственном научно-исследовательском институте особо чистых препаратов Федерального медико-биологического агентства (ФМБА) России завершаются доклинические испытания «Белка теплового шока» — лекарства, которое может совершить революцию в онкологии. Это принципиально новое средство для лечения злокачественных опухолей, полученное с помощью биотехнологий. Ученые предполагают, что оно поможет людям с неизлечимыми сегодня опухолями. Успех в создании препарата был достигнут с помощью космического эксперимента. Об этом корреспонденту «Известий» Валерии Нодельман рассказал замдиректора института по научной работе, член-корреспондент РАН, доктор медицинских наук, профессор Андрей Симбирцев.
- Что является основным действующим веществом нового лекарства от злокачественных образований?
Наш препарат имеет рабочее название «Белок теплового шока» — по основному действующему веществу. Это молекула, которая синтезируется любыми клетками организма человека в ответ на различные стрессорные воздействия. О ее существовании ученые знали давно. Первоначально предполагалось, что белок может только защищать клетку от повреждения. Позже выяснилось, что помимо этого он обладает уникальным свойством — помогает клетке показывать свои опухолевые антигены иммунной системе и тем самым усиливает противоопухолевый иммунный ответ.
- Если организм вырабатывает такие молекулы, почему же он сам не справляется с раком?
Потому что количество этого белка в организме минимально. Его недостаточно для достижения терапевтического эффекта. Также невозможно просто забрать эти молекулы из здоровых клеток, чтобы ввести в больные. Поэтому была разработана особая биотехнология по синтезированию белка в количестве, необходимом для создания препарата. Мы выделили ген человеческой клетки, который отвечает за производство белка, и клонировали его. Затем создали штамм-продуцент и заставили бактериальную клетку синтезировать человеческий белок. Такие клетки хорошо размножаются, что позволило нам получить неограниченное количество белка.
- Ваше изобретение состоит в создании технологии получения «Белка теплового шока»?
Не только. Мы также смогли изучить его структуру, расшифровать механизм противоопухолевого действия на молекулярном уровне. ФМБА обладает уникальной возможностью проводить медицинские исследования с помощью космических программ. Дело в том, что для рентгеноструктурного анализа действия белка необходимо сформировать из него сверхчистый кристалл. Однако в условиях земного притяжения получить его невозможно — белковые кристаллы растут неравномерно. Родилась идея вырастить кристаллы в космосе. Такой эксперимент был проведен в 2015 году. Мы упаковали сверхчистый белок в капиллярные трубочки и отправили их на МКС. За шесть месяцев полета в трубочках сформировались идеальные кристаллы. Они были спущены на землю и проанализированы в России и Японии (там есть сверхмощное оборудование для рентгеноструктурного анализа).
- А эффективность препарата уже доказана?
Мы провели опыты на мышах и крысах, у которых развивались меланомыи саркомы. Курсовое введение препарата в большинстве случаев приводило к полному излечению даже на поздних стадиях. То есть уже можно с уверенностью сказать, что белок обладает необходимой для лечения рака биологической активностью.
Почему вы думаете, что «Белок теплового шока» поможет не только при саркоме, но и при других видах злокачественных образований?
В основе нового препарата — молекула, которая синтезируется всеми видами клеток. Никакой специфичности у нее нет. На другие виды опухолей препарат будет действовать благодаря этой универсальности.
- Нужно ли будет для создания препарата каждый раз отправлять белок в космос?
Нет. Создание кристалла в невесомости требовалось только для научного этапа разработки препарата. Космический эксперимент лишь подтвердил, что мы на правильном пути. А производство будет исключительно земным. Собственно, мы уже изготавливаем препарат на производственных участках НИИ. Он представляет собой раствор белка, который можно вводить пациентам. Мышам мы вводим его внутривенно. Но, возможно, во время клинических испытаний найдем более эффективные подходы — например, оптимальной может оказаться адресная доставка белка в опухоль.
- Есть ли побочные эффекты у нового препарата?
Пока никаких проблем не выявлено. Во время тестирования «Белок теплового шока» не проявил токсичности. Но окончательно мы сможем сделать вывод о полной безопасности препарата только после завершения доклинических исследований. На это потребуется еще год.
- И потом вы сможете начать клинические испытания?
Это целиком зависит от того, удастся ли нам найти источник их финансирования. На доклинический этап мы получили грант от Министерства образования и науки. Клинические исследования стоят очень дорого — около 100 млн рублей. Обычно они проводятся на условиях софинансирования: находится частный инвестор, который вкладывает средства, а государство возвращает 50% в случае успешного завершения. Мы рассчитываем на поддержку Минпромторга или Минздрава.
- А частный инвестор уже найден?
Нет. Нам предстоит большая работа с его поисками. Можно было бы предложить японцам выступить инвесторами, но хочется начать с России, так как это отечественная разработка. Будем стучаться во все двери, потому что препарат уникальный. Мы стоим на пороге открытия совершенно нового средства лечения рака. Оно позволит помочь людям с неизлечимыми опухолями.
- Ведутся ли подобные разработки за рубежом?
Мы слышали о попытках получить препарат «Белка теплового шока» в разных странах. Такие работы ведутся, например, в США, Японии. Но пока никто не опубликовал их результаты. Я надеюсь, что сейчас мы опережаем в этом вопросе зарубежных коллег. Главное — не остановиться на этом пути. А это может случиться только по одной причине — из-за нехватки финансирования.
- Когда реально, при всех благоприятных обстоятельствах, человечество сможет получить лекарство от рака?
Полные клинические испытания обычно проходят два-три года. К сожалению, быстрее не получится — это серьезное исследование. То есть с учетом финальной стадии доклинических исследований пациенты получат новое лекарство через три-четыре года.