Гантели и штанги, которыми бодибилдеры накачивают мускулы, сделаны из стали. Изготовленные из свинца – а лучше из – снаряды значительно потеряли бы в объеме. Но еще вернее использовать для производства гирь осмий: килограмм осмия – это небольшой шарик, легко помещающийся в сжатом кулаке. Поллитровая бутылка с порошковым осмием (именно в таком виде благородный металл покидает стены обогатительного предприятия) весит заметно больше ведра воды.
Вот только лить из осмия гири смелых не сыскать: уж больно тугоплавок. Да и стоимость металла такова, что атлетическому клубу для покупки одной осмиевой гантели пришлось бы работать лет триста...
Осмия мало!
И это понятно. Для формирования тяжелых элементов природе приходится «создавать» особые условия, что случается не слишком часто. Тем не менее, полпроцента массы земной коры приходится на осмий. Есть все основания полагать, что большая часть благородного металла, собранного в теле нашей планеты, сконцентрирована в ядре.В природе осмий встречается в основном в виде соединения с иридием, входящим в состав либо самородной платины, либо платиново-палладиевой руды. Минералы, считающиеся сырьем для добычи осмия, содержат в среднем одну тысячную процента тяжелого «родственника» платины. За все время изысканий не было добыто ни одного осмиевого самородка – даже самого незначительного размера.
Малое количество и сложность получения осмия определяет высоту его цены. Полвека назад осмий оценивался в семь-восемь раз дороже золота. Спекуляции последних лет привели к возникновению совершенно безумных предложений: грамм осмия продавался и за 10 тыс., и за 200 тыс. долларов. Продавался – да не продался: активного применения осмий не находит, хотя кое-где используется.
Открытие осмия
Осмий входит в группу платиноидов и формально считается благородным металлом. Название химического элемента, однако, противоречит статусу: «осме» по-гречески значит «запах»; наличие запаха свидетельствует о значительной химической активности – в то время как «благородство» веществ подразумевает инертность.К открытию осмия был близок У. Уолластон, экспериментировавший с платиновыми рудами. Раззадоренные его успехами французы Антуан де Фуркруа и Луи-Николя Воклен взялись за собственные исследования и верно предположили существование нового элемента, при опытах улетучивавшегося в виде черного дыма.
Фуркруа и Воклен дали веществу имя «птен» - что значит «летучий», и успокоились в ожидании признания. Однако английский химик Смитсон Теннант разделил «птен» на два родственных металла, один из которых за разноцветье его соединений назвал иридием, а второй – по причине раздражающей вонючести – осмием.
Происходят эти важные события в щедром на открытия 1803-м году.
Свойства осмия
Исследовать физико-химические свойства осмия во всей их полноте не получается до сих пор. Довольно долго ученые спорили о том, какой из металлов плотнее – иридий или осмий. Точные измерения лабораторных образцов в данном случае дают лишь примерный результат – из-за большого количества разных по плотности изотопов.Температура плавления и кипения до недавнего времени считалась условно равной 3000° и 5000°С: средств для натурной проверки расчетов не существовало. Лишь несколько лет назад удалось уточнить физические параметры металла. По всему вышло, что варить осмиевые сплавы лучше на поверхности Солнца...
Интересен внешний вид осмия. Застывая из расплава, осмий образует твердые и хрупкие кристаллы, серебристый блеск которых оттенен серовато-голубым (и даже синим) отливом. Внешние достоинства осмия могли бы привлечь ювелиров, однако высокая химическая активность металла и токсичность его соединений исключают возможность использования этого платиноида в украшениях.
Применение осмия
Осмий находит весьма ограниченное применение в разных сферах человеческой деятельности. Легирование сплавов – одна из главных задач, решение которой иногда возлагается на осмий. В соединении с вольфрамом, никелем и кобальтом осмий становится «работником» электрохимической отрасли. Контакты, наконечники и сердечники из содержащих осмий сплавов славятся минимальным износом. Нити ламп накаливания из вольфрама с осмием работают дольше и большей отдачей.Внедрение твердого и тяжелого платиноида в материал резко повышает износостойкость трущихся пар. Совсем немного осмия нужно для придания металлокерамическому резцу особой прочности. Микроскопические добавки осмия к стали режущих сортов позволяет создавать острейшие лезвия технических, медицинских, промышленных ножей.
Осмиевые катализаторы используются при гидрировании органических соединений, в производстве лекарств, при синтезе аммиака. Правда, дороговизна металла заставляет промышленников искать доступные заменители, и сегодня осмий в химической индустрии встречается все реже.
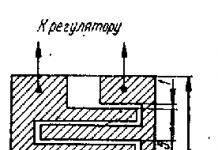
Из твердого и немагнитного осмия изготавливают оси, опоры и опорные гнезда для измерительных приборов высокой точности. И хотя рубиновые опоры тверже и дешевле осмиевых, стойкость металла иногда оказывается предпочтительной для приборостроения.
Осмий опасен и требует осторожности
Сам по себе осмий не более опасен, чем любой другой тяжелый металл. Однако тетраоксид осмия OsO4 – то самое вещество, из-за которого элемент получил не слишком завидное наименование – отличается крайней агрессивностью. Раздражая дыхательные пути и слизистые оболочки человека, он воспринимается как испарение от гниющей редьки, смешанной с давленым чесноком и засыпанной хлорной известью.Избежать окисления осмия практически невозможно , если металл контактирует с атмосферным кислородом. Поэтому ни о каком использовании осмия в
Осмий (лат. Osmium) - химический элемент с атомным номером 76 в Периодической системе химических элементов Д. И. Менделеева, обозначается символом Os. При стандартных условиях представляет собой блестящий серебристо-белый с голубоватым отливом металл.
Осмий самый тяжелый из всех металлов (его плотность 22,6 г/см3) и один из самых твердых, но при этом хрупкий, и из него легко получается порошок. Он является переходным металлом и относится к платиновой группе.
Осмий открыт в 1804 английским химиком С. Теннантом в черном порошке, остающемся после растворения платины в царской водке. Для него характерно образование тетраоксида OsO 4 с резким запахом. Отсюда и название элемента, происходящее от греческого «осме» - запах.
Внешне осмий мало отличается от других металлов платиновой группы, но именно у него самые высокие температуры плавления и кипения среди всех металлов этой группы, именно он наиболее тяжел. Его же можно считать наименее «благородным» из платиноидов, поскольку в мелкораздробленном состоянии кислородом воздуха он окисляется уже при комнатной температуре.
ФИЗИЧЕСКИЕ СВОЙСТВА ОСМИЯ
Осмий самый плотный драгоценный металл . Он по плотности немного превосходит платиновый элемент - иридий. Наиболее достоверные значения плотностей для этих металлов могут быть рассчитаны по параметрам их кристаллических решёток: 22,562 ± 0,009 г/см3 для иридия и 22,587 ± 0,009 г/см3 для осмия. По новейшим сведениям, плотность осмия составляет 22,61 г/см3.
В силу своей твёрдости, хрупкости, низкого давления паров (самого низкого среди всех платиновых металлов), а также очень высокой температуры плавления, осмий с трудом поддаётся механической обработке.
Термодинамические свойства:
- температура плавления 3327 K (3054 °C);
- температура кипения 5300 K (5027 °C);
- теплота плавления 31,7 кДж/моль;
- теплота испарения 738 кДж/моль;
- теплопроводность (300 K) (87,6) Вт/(м·К);
- температура перехода в сверхпроводящее состояние - 0,66 К;
- молярная теплоёмкость 24,7 Дж/(K·моль).
Молярный объём 8,43 см3/моль.
Структура решётки гексагональная.
Твёрдость по Виккерсу 3 - 4 ГПа, по шкале Мооса – 7.
Модуль нормальной упругости - 56,7 ГПа.
Модуль сдвига - 22 ГПа.
Осмий - парамагнетик (магнитная восприимчивость 9,9·10-6).
В природе осмий встречается в виде семи изотопов, 6 из которых стабильны: 184Os (0,018 %), 187Os (1,64 %), 188Os (13,3 %), 189Os (16,1 %), 190Os (26,4 %) и 192Os (41,1 %). Осмий-186 (содержание в земной коре 1,59 %) подвержен альфа-распаду, но учитывая его исключительно большой период полураспада - (2,0 ± 1,1)·1015 лет, его можно считать практически стабильным. Искусственным путём получены радиоактивные изотопы осмия с массовыми числами от 162 до 197, а также несколько ядерных изомеров. Самый долгоживущий осмий-194 с периодом полураспада около 700 дней.
ХИМИЧЕСКИЕ СВОЙСТВА ОСМИЯ
Порошок осмия при нагревании реагирует с кислородом, галогенами, парами серы, селеном, теллуром, фосфором, азотной и серной кислотами. Компактный осмий не взаимодействует ни с кислотами, ни со щелочами, но с расплавами щелочей образует водорастворимые осматы. Медленно реагирует с азотной кислотой и царской водкой, реагирует с расплавленными щелочами в присутствии окислителей (нитрата или хлората калия), с расплавленной перекисью натрия. В соединениях проявляет степени окисления от -2 до +8, из которых самыми распространёнными являются +2, +3, +4 и +8. Металлический осмий и все его соединения электрохимически легко окисляются до OsO4.
Для осмия, в отличие от большинства элементов VIII группы, характерна валентность 8+, и он образует с кислородом устойчивую четырехокись OsO4. Это своеобразное соединение, несомненно, является его самым важным.
Внешне чистая четырехокись осмия выглядит достаточно обычно – бледно-желтые кристаллы, растворимые в воде и четыреххлористом углероде. При температуре около 40°C (есть две модификации OsO4 с близкими точками плавления) они плавятся, а при 130°C четырехокись осмия закипает.
Как и элементарный осмий, OsO4 обладает каталитическими свойствами; OsO4 применяют при синтезе важнейшего современного лекарственного препарата – кортизона.
Оксид осмия очень летуч, его пары OsO4 ядовиты, разъедают слизистые оболочки. Он имеет кислотные свойства, образует соединения типа K2OsO4.
Другой окисел осмия – OsO2 – нерастворимый в воде черный порошок – практического значения не имеет. Также не нашли пока практического применения и другие известные его соединения – хлориды и фториды, иодиды и оксихлориды, сульфид OsS2 и теллурид OsTe2 – черные вещества со структурой пирита, а также многочисленные комплексы и большинство сплавов осмия.
Для осмия сейчас известны два карбонила. Пентакарбонил Os(CO)5 – в обычных условиях бесцветная жидкость (температура плавления – 15°C). Получают его при 300°C и 300 атм. из четырехокиси осмия и угарного газа. При обычных температуре и давлении Os(CO)5 постепенно переходит в другой карбонил состава Os3(CO)12 – желтое кристаллическое вещество, плавящееся при 224°C.
Нахождение в природе
В природе осмий встречается в основном в виде соединения с иридием, входящим в состав либо самородной платины , либо платиново-палладиевой руды. Минералы, считающиеся сырьем для добычи осмия, содержат в среднем одну тысячную процента тяжелого «родственника» платины. За все время изысканий не было добыто ни одного осмиевого самородка – даже самого незначительного размера.
Основные минералы осмия, относящиеся к классу твёрдых растворов, природные сплавы осмия и иридия (невьянскит и сысертскит). Самый распространенный из них – невьянскит, природный сплав этих двух металлов. Иридия в нем больше, поэтому невьянскит часто называют просто осмистым иридием. Зато другой минерал – сысертскит – называют иридистым осмием – в нем больше осмия. Оба эти минерала тяжелые, с металлическим блеском и очень редки.
Основные месторождения осмистых иридиев сосредоточены в России (Сибирь, Урал), США (Аляска, Калифорния), Колумбии, Канаде, странах Южной Африки, Тасмании, Австралии.
Несмотря на то, что месторождения осмия расположены по всему миру, единственным производителем 187 изотопа является Казахстан. Эта страна лидирует по запасам ценного осмия-187, являясь и единственным экспортером изотопа.
Получение осмия
Чтобы отделить от платины осмистый иридий её растворяют в царской водке, минералы группы осмистого иридия остаются в осадке. Далее полученный осадок сплавляют с восьмикратным количеством цинка – этот сплав сравнительно просто превратить в порошок, который спекают с перекисью бария BaO3. Затем полученную массу обрабатывают смесью азотной и соляной кислот непосредственно в перегонном аппарате – для отгонки OsO4.
Тетраоксид осмия улавливают щелочным раствором и получают соль состава Na2OsO4. Раствор этой соли обрабатывают гипосульфитом, после чего осмий осаждают хлористым аммонием в виде соли Фреми Cl2. Осадок промывают, фильтруют, а затем прокаливают в восстановительном пламени. Так получают пока еще недостаточно чистый губчатый осмий.
Затем его очищают, обрабатывая кислотами (HF и HCl), и довосстанавливают в электропечи в струе водорода. После охлаждения получают металл чистотой до 99,9% Os.
Такова классическая схема получения осмия – металла, который применяют пока крайне ограниченно, металла очень дорогого, но достаточно полезного. Мировое производство осмий составляет всего около 600 кг в год.
Все страны, добывающие осмий, не экспортируют его. Все, кроме Казахстана. Это единственная страна, которая продавала полученный осмий в лабораториях по цене 100 000 долларов за грамм. Однако на сегодняшний день продажи прекращены. Приобрести осмий можно только на черном рынке , где много лет зафиксировалась цена за 1 грамм в 200 000 долларов.
Применение
Осмий используется во многих сплавах, что делает их очень износостойкими. Если добавить осмий в какой-нибудь сплав, то он тут же приобретает неимоверную износостойкость, становится долговечным, повышается его сопротивляемость механическим воздействиям и коррозиям.
Легирование сплавов – одна из главных задач, решение которой иногда возлагается на осмий. В соединении с вольфрамом, никелем и кобальтом осмий становится «работником» электрохимической отрасли. Контакты, наконечники и сердечники из содержащих осмий сплавов славятся минимальным износом.
Внедрение твердого и тяжелого платиноида в материал резко повышает износостойкость трущихся пар. Совсем немного осмия нужно для придания металлокерамическому резцу особой прочности. Микроскопические добавки осмия к стали режущих сортов позволяют создавать острейшие лезвия технических, медицинских, промышленных ножей.
Сплав платины (90 %) и осмия (10 %) применяется в хирургических имплантатах, таких, как электрокардиостимуляторы, и при замещении клапанов лёгочного ствола.
Сплав «осрам» (осмия с вольфрамом) использовался для изготовления нитей ламп накаливания.
Поскольку осмий не имеет магнитных свойств, его активно используют при создании часовых механизмов и компасов.
Осмиевые катализаторы используются при гидрировании органических соединений, в производстве лекарств, при синтезе аммиака. Тетраоксид (высший оксид, OsO4) осмия находит своё применение, как катализатор, при производстве некоторых синтетических лекарств, а также в лабораторных исследованиях – с его помощью удобно окрашивать ткани под микроскопом.
Из твердого и немагнитного осмия изготавливают оси, опоры и опорные гнезда для измерительных приборов высокой точности. И хотя рубиновые опоры тверже и дешевле осмиевых, стойкость металла иногда оказывается предпочтительной для приборостроения.
Биологическая роль и физиологическое действие
Современные ученые уверены, что биологической роли данный металл не играет. Однако, этот элемент классифицируется как крайне агрессивный, наряду с такими металлами как ртуть, бериллий и висмут.
Даже малые количества осмия в воздухе вызывают у человека поражение глаз – боль, слезотечение и конъюнктивит; во рту появляется металлический привкус, а в бронхах – спазмы; дышать становится трудно, и это может продолжаться несколько часов после того, как источник отравления ликвидирован. Если осмий действует на человека дольше, он может вызвать слепоту, заболевания лёгких и нервной системы, нарушения пищеварения и работы почек – возможен даже смертельный исход.
Кроме того, от этого микроэлемента страдают кожные покровы человека. Они могут приобретать зеленый и черный цвета, на коже могут появляться воспаления, раны и волдыри. Кожа человека может потерять чувствительность и омертветь. Язвы при таком отравлении, затягиваются очень длительное время.
Особенно опасен летучий тетраоксид осмия. Он образуется в процессе выделения данного элемента из платинового сырья. Это то самое вещество, из-за которого элемент получил не слишком завидное наименование. Раздражая дыхательные пути и слизистые оболочки человека, он воспринимается как испарение от гниющей редьки, смешанной с давленым чесноком и засыпанной хлорной известью.
Получить интоксикацию осмием можно на различных производствах. Ученые считают, что в помещениях этого вещества быть не должно даже в очень малых дозах.
Осмий представляет собой химический элемент из соответствующей системы химических элементов. В обычном состоянии является переходным металлом платиновой группы в виде блестящего белого металла серебристого оттенка с голубым отливом. Данный вид материалов обладает наибольшим показателем плотности среди других наряду с иридием, однако, последний немного проигрывает.
Этот вид материалов выделяют из сырья платиновых металлов обогащенного типа, путем прокалывания при температуре от 800 до 900 градусов Цельсия на воздухе.
Таблица удельного веса осмия
Так как, осмий является сложным материалом, рассчитать его удельный вес в полевых условиях самостоятельно не представляется возможным. Эти вычисления проводят в специальных химических лабораториях. Однако, при этом средний удельный вес осмия известен и равен 22,61 г/см3.
Для упрощения подсчетов ниже представлена таблица с значениями удельного веса осмия, а также его веса в зависимости от единиц исчисления.
Свойства осмия
Данный материал является хрупким, но в тоже время, очень твердым металлом с большой удельной массой. Механической обработке поддается с трудом, из-за хрупкости, твердости и высокой температуре плавления, а также низкого давления паров. Температура плавления осмия составляет 3033 градусов Цельсия, а кипения 5012 градусов Цельсия. Данный вид материалов относят к группе парамагнетиков.
Осмий в состоянии порошка хорошо реагирует с галогенами, селеном, фосфором, кислородом, парами серы, серной и азотной кислотой при нагревании. Не взаимодействует в компактном виде с щелочами и кислотами. Обладает низкой скоростью реакции с царской водкой и азотной кислотой.
Данный вид материалов является одним из немногих металлов, которые образуют кластерные или полиядерные соединения.
Не оказывает никакого влияния на биологическую роль живых организмов и является крайне токсичным.
Получение осмия
В естественном виде в природе не найден. Этот материал всегда связан с другим видом металла платиновой группы - иридием. Добывают осмий наряду с платиной. При обработке которой выделяется осмистый иридий, который разделяют на отдельные компоненты - иридий и осмий. Затем осмий очищают, поддают процессу обработки кислотами и восстанавливают водородом в электропечи, получая в итоге, чистый металл с концентрацией до 99,9 процентов.
Применение осмия
Широкое распространение получил как катализатор реакций и компонент сплавов с иридием. Из основных направлений следует выделить:
Порядковый элемент с номером атома 76 в химической системе Д.И. Менделеева называется осмий. В твердом виде металл блестящего серебристо-белого цвета с синеватыми переливами. Считается тяжелым металлом, плотность осмия равна 22,6 г/см3. Но в то же время хрупкий и из него можно изготовить порошок. Именно в этом состоянии был открыт металл английским химиком С. Теннантом. Металл переходный, входит в платиновую группу. В мелком состоянии поддаётся окислению при комнатной температуре.
Свойства осмия
Драгоценный металл самый плотный (22,61 г/см3) и тугоплавкий. Физические свойства осмия следующие:
1. Плавится при температуре 3047 °C., закипает — 5025°С, не перерабатывается механическим способом, нельзя растворить в кислоте и «царской водке».
2. Запах у него неприятный, напоминает смесь чеснока и хлорки, добавляют для придания сплаву платины твёрдости и упругости.
3. Атомная масса осмия составляет 190,23 г/моль.
4. Изотоп 187 является результатом распада изотопа рения. Благодаря химической инертности сплав из осмия используют в агрессивной кислотной среде.
5. Металл хорошо измельчается, в форме порошка фиолетового цвета медленно растворяется в кислотах, реагирует на такие соединения, как сера, селен, теллур и фосфор.
6. В рассыпчатом состоянии реагирует с ртутью, получается амальгам осмия.
7. При взаимодействии с другими веществами выделяет нехороший запах.
8. Внешне кристаллы выглядят красиво. После воздействия на него большой температуры он плавится, образуя твердые и хрупкие кристаллы. Цвет у металла серо-голубой с серебристым блеском.
Его внешние данные могли бы оценить ювелиры, но из-за его токсичности и химического взаимодействия с другими элементами не применяется для выпуска ювелирных изделий.
Земная кора на 0,5% состоит из этого металла, преимущественно в центре земли – ядре. Кусок металла, как яйцо, весит один килограмм. Если в тару 0,5 литра насыпать порошка из этого вещества, его вес составит 16 кг.
Химические свойства благородного металла следующие:
- в твердом состоянии окисляется при температуре более 400 C, в порошке уже реагирует при комнатной температуре (OsO4);
- при нагреве взаимодействует с серой, хлором, фтором, серой и другими химическими элементами;
- в кипящей соляной кислоте не растворяется, а в мелко раздробленном виде соединяется с молекулами азотной кислоты и окисляется: Os + 8HNO3 = OsO4 + 4H2O + 8NO2;
- диоксид осмия OsO2 черного цвета выделяют при обезвоживании в атмосфере азота;
- Гидроксил осмия (IV)Os(OH)4 (OsO2 2H2O) получают путем восстановления солей металла(VI).
В природе существует шесть изотопов, один из 186 изотоп распадается на соединения альфа-группы. Дольше всех существует осмий — 194 с полураспадом в два года. Осмий мало чем выделяется из своих собратьев группы платиноидов (рутений, палладий, осмий, иридий, платина), но превосходит другие металлы из-за своей плотности и способности закипать в очень большой температуре.
Встречается в природе в самородном виде как твёрдый раствор с иридием (минералы невьянскит и сысертскит).
Применение
Добавление осмия в различные сплавы делает их более устойчивыми, долговечными, не подверженными механизации и коррозии.
- Электрохимическая промышленность: используется в соединениях вольфрама, никеля и кобальта. Все изделия получаются износостойкие.
- Внедрение металла платиновой группы в металлические изделия повышает их прочность. Совсем немного нужно вещества, чтобы создать острые лезвия, изделия медицинского назначения и технические изделия.
- Авторучки с наконечниками долго не стираются.
- В кардиологии: назначение металл нашёл в имплантатах (электрокардиостимулятор) и при замещении клапанов лёгочного ствола.
- В соединение с вольфрамом используется для производства нитей для электрических ламп.
- Не обладает магнитным притяжением, благодаря чему нашёл свое применение в изготовлении деталей для часов.
- Катализаторы из него используют в производстве лекарственных препаратов, синтезируют аммиак. Высший оксид этого металла применяется в производстве искусственных лекарств и в лаборатории – им окрашивают ткани под микроскопом.
- Твердый металл применяется в изготовлении опоры и осей для высокоточных приборов измерения. Из-за твердости металл используют в приборостроении.
- Осмий 187 и другие изотопы применяется в тяжелой промышленности: ракетостроении, авиалайнерах, военной технике. Благодаря своей износостойкости помогает выдержать экстремальные условия.
История открытия
Осмий – благородный металл. Но это противоречит его статусу: в переводе с греческого «осме» означает запах, то есть химически активный. А благородство подразумевает инертность этого вещества.
Открытие осмия состоялось в 1803 году. Английский химик С.Теннант в сотрудничестве с Уильямом Х. Уолластоном производили опыт с растворением в царской водке осмия, но ничего из этого не вышло. Похожие испытания провели французские химики Колле-Дескоти, Антуан де Фуркруа и Воклен. Они обнаружили в этом элементе нерастворимый осадок платиновой руды. Химическому элементу присвоили имя птен, от греческого слова означает летящий. Этим опытом они доказали присутствие двух химических веществ - осмия и иридия.
Где он в природе и как его получают
В природе благородный металл в самородках не существует. Его добывают из следующих пород – сысертскит, невьянскит, осмиирид и сарсит. Он входит в состав медных, молибденовых и никелевых руд. По некоторым данным содержится в соединениях мышьяка и серы.
Доля вещества на планете составляет 0,000005% от общей массы всех горных пород. В природе осмий соединяется с иридием, процентное соотношение которого колеблется от 10 до 50. В Африке, Тасмании, Австралии, Соединенных Штатах, Канаде, Колумбии, России есть запасы этого металла. Самая богатая страна по содержанию осмия – ЮАР (месторождение Бушвельдского комплекса). Благородный металл можно встретить в сплавах самородной платины, но чаще в сплавах осмия и иридия.
Рассыпчатое состояние - это наиболее приемлемая форма существования. В таком виде он лучше вступает в химические реакции и подвергается термической обработке. Металл платиновой группы можно получить следующими способами:
- использование электронного луча;
- дуговой нагрев;
- применение бестигельной зонной плавки.
Кристаллы, полученные последним способом очень дорогие. Кто-то умудрялся выращивать кристаллы из порошка, но метод трудный и затрачивает много времени.
Стоимость
В природе металла довольно мало, а добыть осмий – затратный проект, поэтому этим обусловлена его цена на рынке. В 60–70 годы XX века драгметалл был дороже в несколько раз золота. Продавали дешёво, а ценился он дорого, из-за этого предложения на рынке были ошеломляющие: грамм металла оценивался в 10 тыс., и за 200 тыс. долларов. Золото так не ценится, как его собрат платиновой группы.
Чем опасен осмий
Химическое соединение с осмием повреждает человеческие органы. Вдыхание паров приводит к смертельному исходу. У животных при интоксикации наблюдалось малокровие, и нарушалась функция легких.
А вы знаете, что тетра оксид осмия OsO4 довольно агрессивное соединение, и если отравится, на коже появляются пузырьки зеленого или черного цвета. Человеку приходится нелегко, так как лечиться придётся долго.
Тем, кто трудится на опасных производствах, следует относиться к себе осторожно. Для этого на предприятиях выдают защитные костюмы и респираторы.