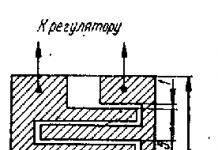
Материалы представлены из учебного пособия РУДН
Анемии. Клиника, диагностика и лечение / Стуклов Н.И., Альпидовский В.К., Огурцов П.П. – М.: ООО «Медицинское информационное агентство», 2013. – 264 с.
Копирование и тиражирование материалов без указания авторов запрещено и преследуется по закону.
Миелодиспластический синдром (МДС) объединяет группу приобретенных заболеваний кроветворной системы, при которой патологический процесс начинается на уровне полипотентной стволовой клетки и обнаруживает себя нарушением пролиферации и дифференцировки клеток одного, двух или трех ростков кроветворения с их последующей гибелью в костном мозге (неэффективный эритропоэз).
В отличие от АА, стволовые клетки присутствуют в костном мозге больных МДС, хотя они функционально неполноценны. Костный мозг при МДС чаще бывает гиперклеточным, нормоклеточным и реже – гипоклеточным, тогда как в периферической крови обнаруживается рефрактерная анемия, нередко лейко- и/или тромбоцитопения.
В основе функциональной патологии полипотентных стволовых клеток лежат хромосомные изменения, которые обнаруживаются у большинства больных МДС. Они имеют клональный характер, аналогичный цитогенетическим изменениям при лейкозах. Хромосомные изменения при МДС разнообразны и включают транслокацию, инверсию и делецию хромосом. К наиболее характерным относятся: трисомия 8, моносомия 5, моносомия 7, делеция Y-хромосомы, делеция длинного плеча 7 (7q-), 11 (11q-), 13 (13q-), 20 (20q-), а также транслокации t(1;3), t(5;7), t(2;11), t(6;9), t(11;27), инверсия 3 хромосомы. У 20% больных наблюдаются множественные нарушения. Часто встречается делеция длинного плеча хромосомы 5 (у 30% больных). Причем установлено, что с этим плечом 5 хромосомы утрачиваются гены, отвечающие за синтез многих ростковых факторов, в том числе гранулоцитарно-макрофагального, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6 и многих других биологически активных веществ, регулирующих кроветворение.
Форма с подобной хромосомной патологией была даже выделена среди больных МДС в 5 q -синдром, который чаще встречается у женщин, характеризуется рефрактерной мегалобластной анемией и редко трансформируется в острый лейкоз (менее 5% больных).
Причины, вызывающие хромосомную патологию, неясны. В ряде случаев предполагается действие таких мутагенных факторов, как ионизирующая радиация, действие химических и лекарственных факторов.
Возникшая в костном мозге в одной полипотентной стволовой клетке цитогенетическая патология, обуславливающая в дальнейшем развитие МДС, способна воспроизводиться в потомках смутировавшей стволовой клетки, формируя таким образом патологический клон, клетки которого не способны к нормальной пролиферации и дифференцировке, что внешне проявляется их морфологической дисплазией и последующей костномозговой гибелью (неэффективный эритропоэз). Установлено, что 75% костного мозга при МДС имеют CD 95, маркер запрограммированной клеточной гибели – апоптоза. Это обуславливает различные типы цитопений в периферической крови больных МДС.
Заболеваемость МДС составляет 3 – 15 случаев на 100000 населения и частота его повышается до 30 случаев у людей старше 70 лет и 70 случаев – в возрасте старше 80 лет. Средний возраст больных – 60 – 65 лет, у детей МДС встречается крайне редко.
Клиника
Клиническая картина МДС не имеет специфических особенностей. Основные симптомы зависят от глубины и сочетания поражения ростков кроветворения. Основным признаком болезни является рефрактерный анемический синдром, проявляющийся нарастающей слабостью, повышенной утомляемостью и другими свойственными анемии симптомами. У больных МДС с лейкопенией нередко возникают инфекционные осложнения (бронхиты, пневмонии идр.). Геморрагический синдром вследствие тромбоцитопении наблюдается у 10 – 30% больных, и проявляется кровоизлияниями на коже и видимых слизистых, кровоточивостью десен и носовыми кровотечениями.
Какой – либо характерной органной патологии при МДС нет: периферические лимфоузлы, печень и селезенка не увеличены.
Лабораторные данные.
Анемия различной степени выраженности наблюдается практически у всех больных МДС и чаще носит макроцитарный характер. Очень редко наблюдается гипохромия эритроцитов. Нередко присутствуют эллиптоциты, стоматоциты и акантоциты, а также базофильная пунктация и тельца Жолли в эритроцитах. В крови могут присутствовать ядросодержащие клетки красного ряда. Количество ретикулоцитов чаще сниженное.
Часто у больных в анализах крови имеется стойкая нейтропения , причем для гранулоцитов характерно наличие псевдопельгеровской аномалии (лейкоциты с двудольчатыми ядрами и дегрануляцией цитоплазмы).
Тромбоцитопения встречается у половины больных МДС. Среди тромбоцитов встречаются гигантские и дегранулированные формы.
У части больных МДС в анализах крови могут встречаться бластные клетки .
Костный мозг при МДС обычно гиперклеточный, но может быть нормоклеточным, а в редких случаях – даже гипоклеточным. Однако, всегда присутствуют черты дисэритропоэза : мегалобластоидность, многоядерность эритробластов, наличие митозов, патологических делений и ядерных аномалий, мостиков между ними, базофильная пунктация и вакуолизация цитоплазмы. У части больных в костном мозге повышено содержание сидеробластов с кольцевым расположением гранул железа вокруг ядра клетки.
Нарушение дифференцировки предшественников эритроцитов при МДС проявляется повышенным содержанием в них HbF (уровень которого в зрелых эритроцитах нормальный) и наличием в эритробластах пероксидазы и щелочной фосфатазы, что является характерным для нейтрофилов.
Дисгранулоцитопоэз в костном мозге проявляется задержкой созревания гранулоцитов на уровне миелоцитов, нарушением процесса грануляции цитоплазмы и снижением активности щелочной фосфатазы, что свидетельствует об их функциональной неполноценности, часто встречается гипо – или гиперсегментация ядер нейтрофилов.
Дисмегакариоцитопоэз характеризуется преобладанием микроформ и нарушенной отшнуровкой тромбоцитов.
При некоторых формах МДС выявляется повышенное содержание в костном мозге бластных клеток (от 5 до 20%).
При гистологическом исследовании костного мозга, полученного методом трепанобиопсии, у ряда больных имеет место повышенное образование ретикулиновых волокон, причем резко выраженный миелофиброз наблюдается у 10 – 15% больных МДС. Этому варианту МДС, характеризующемуся более выраженной гиперплазией и дисплазией клеток мегакариоцитарного ростка, с почти 100% наличием хромосомных аномалий, свойственны более выраженная анемия, тромбоцитопения и относительно короткая продолжительность жизни больных (медиана выживаемости 9 – 10 мес.).
Диагностика МДС основывается на наличии рефрактерной анемии, устойчивой к терапии витамином B 12 , фолиевой кислотой, железом и другими гематиками, которая нередко сочетается с нейтро- и тромбоцитопенией и наличием в пунктате костного мозга морфологических признаков дисгематопоэза (нарушения созревания кроветворных клеток).
Классификация МДС:
В настоящее время в клинической практике используются две классификации: Франко-американо-британской группы ( FAB ) 1982 года и Всемирной организации здравоохранения (ВОЗ) 2008 годам.
Дифференциальный диагноз
РА чаще всего приходится дифференцировать от витамин- B 12 - и фолиево-дефицитной анемий, при которых также имеется мегалобластное кроветворение и морфологические признаки дисплазии клеток красного ростка, свидетельствующие о неэффективном эритропоэзе. Быстрые клинический и гематологический ответы на терапию витамином B 12 или фолиевой кислотой указывают на причинную взаимосвязь между анемией и дефицитом этих витаминов.
РАКС необходимо дифференцировать с приобретенной сидеробластной анемией, обусловленной хронической свинцовой интоксикацией. РЦМД, при которой имеется панцитопения в периферической крови, напоминает апластическую анемию. Наличие нормальной клеточности костного мозга с морфологическими признаками дисмиелопоэза позволяет правильно верифицировать диагноз.
Классификация МДС (ВОЗ, 2008)
|
Нозологическая форма МДС |
Изменения в крови |
Изменения в костном мозге |
|
Рефрактерная анемия (РА) |
Анемия Бласты < 1% Моноциты < 1 х 10 9 / л |
- дисплазия кроветворения < 10% в одном ростке кроветворения Бласты < 5% - кольцевые сидеробласты < 15% |
|
Рефрактерная нейтропения (РН) |
Нейтропения Бласты < 1% Моноциты < 1 х 10 9 / л |
|
|
Рефрактерная тромбоцитопения (РТ) |
- тромбоцитопения Бласты < 1% Моноциты < 1 х 10 9 / л |
|
|
Рефрактерная анемия с кольцевыми сидеробластами (РАКС) |
Анемия Бласты < 1% Моноциты < 1 х 10 9 / л |
- дисплазия кроветворения. Бласты < 5% - кольцевые сидеробласты > 15% |
|
Рефрактерная цитопения с многоростковой дисплазией (РЦМД) |
- цитопения по 2 – 3 росткам Бласты < 1% - моноциты < 1 х 10 9 /л |
- дисплазия кроветворения < 10% в двух и более ростках кроветворения Бласты < 5% - кольцевые сидеробласты (любое количество) |
|
Рефрактерная анемия с избытком бластов I (РАИБ-1) |
Цитопения любая Бласты < 5% - моноциты < 1 х 10 9 /л |
Бласты 5 – 9% |
|
Рефрактерная анемия с избытком бластов II (РАИБ-2) |
Цитопения любая Бласты 5 – 19% - моноциты < 1 х 10 9 /л |
- множественная дисплазия во всех ростках кроветворения Бласты 10 – 19% Палочки Ауэра ± |
|
МДС неклассифици-рованный (МДС-Н) |
Цитопения любая Бласты <1% |
- дисплазия кроветворения < 10% в одном или несколь- ких ростках кроветворения Бласты < 5% |
|
Синдром 5q- |
Анемия Бласты < 1% - тромбоциты норма или увеличены |
- нормальное или увеличенное количество мегакариоцитов с гипосегментированными ядрами - изолированная делеция 5q Бласты < 5% |
Гипопластический вариант МДС отличить от АА значительно труднее. В пользу гипоплазии при МДС говорит наличие хромосомной патологии, отсутствующей при АА, высокое содержание на гемопоэтических клетках проапоптических белков ( CD 95) и низкий уровень щелочной фосфатазы в гранулоцитах при МДС в отличие от нормального содержания этого фермента при АА.МДС с избытком бластов отличается от острого лейкоза по количественному содержанию бластных клеток в костном мозге: все случаи с бластозом более 20% рассматриваются как острый лейкоз.
Лечение
Симптоматическая терапия
Ведущее место в лечении МДС занимает поддерживающая терапия, в первую очередь – переливание эритроцитарной массы, сопровождающееся введением десферала или деферазирокса для удаления избытка железа. Переливание эритроцитарной массы показано при снижении уровня Hb до 80 г/л и ниже, а частота ее зависит от динамики показателей красной крови. Для борьбы с геморрагическим диатезом используется введение тромбоконцентрата, показания те же, что и при лечении АА. При инфекционных осложнениях, обусловленных гранулоцитопенией, показано введение антибиотиков.
Патогенетическая терапия зависит от количества бластов к костном мозге. При выраженом бластозе (> 10%) необходимо регулярно проводить стернальные пункции, чтобы исключить трансформацию МДС в острый лейкоз ( acuteleukemia , AL ). При увеличении бластов больше 20% терапия проводится по программам лечения AL .
Алгоритм лечения МДС (Савченко В.Г., Кохно А.В., Паровичникова Е.Н.)
|
Клеточность костного мозга |
|||
|
Гипоклеточный костный мозг |
Нормо / гиперклеточный костный мозг |
||
|
< 5% бластов |
5 – 20% бластов |
< 5% бластов |
5 – 20% бластов |
|
СуА |
СуА |
рчЭПО |
Децитабин, азацитидин |
|
АТГ |
АТГ |
Спленэктомия |
FLAG, 7 + 3 |
|
Спленэктомия |
Децитабин, азацитидин |
Интерферон-α |
МДЦ – 14 дней |
|
рчЭПО |
МДЦ – 14 дней, 6 – МП, мельфалан |
Децитабин, азацитидин |
6 – МП |
В случаях количества бластов в костном мозге стойко ниже 20% для принятия решения о тактике лечения необходимо проведение трепанобиопсии, которая позволяет установить клеточность костного мозга. После чего терапия МДС может быть направлена на стимулирование кроветворения при гипоплазии костного мозга (рекомбинантный человеческий эритропоэтин – рч-ЭПО), иммуносупрессию с целью активации стволовых клеток (АТГ, CyA ), снижение гемолиза и секвестрации клеток крови (спленэктомия). При гиперклеточных вариантах или формах МДС с бластозом более 5% лечение должно включать подавление опухолевого роста (химиотерапию). В России наиболее подходящий алгоритм выбора терапии МДС, схема которого указана в таблице, сформулирован специалистами Гематологического научного центра: Савченко В.Г., Кохно А.В., Паровичниковой Е.Н. в 2012 году.
В последние годы для стимуляции эритропоэза у больных МДС, иногда успешно, используется рчЭПО: рекормон, эритростим, эпрекс, аранесп и др., который особенно эффективен при низкой концентрации в крови нативного ЭПО (< 500 ед/мл). РчЭПО рекомендуется применять в дозе 100000 МЕ 3 раза в неделю подкожно или по 30000 – 40000 МЕ раз в неделю (при использовании пролонгированных форм эритропоэтина). Терапия считается эффективной при приросте гемоглобина более чем на 10 г/л за 4 – 8 недель или снижение зависимости от гемотрансфузий. Целевая концентрация гемоглобина 120 г/л. Через 2 месяца лечения рчЭПО сообщается о положительном эффекте у 41,6% больных с РА и у 76% больных с РАКС, причем к 6 месяцу этот эффект сохраняется соответственно у 33% и 58%. Таким образом, наиболее эффективным применение ЭПО оказалось у больных при варианте МДС-РАКС.
У белее чем трети больных МДС тяжесть тромбоцитопении может быть временно снижена введением интерферона-α, это позволяет избежать аллоиммунизации, обусловленной введением тромбоконцентрата.Терапия глюкокортикоидами при МДС не эффективна, хотя иногда может уменьшить интенсивность геморрагического синдрома.
У больных МДС с гипопластической фазой заболевания, как и при АА, эффективным оказалось проведение иммуносупрессивной терапии (СуА), которая не только блокирует действие Т-клеток-супрессоров, но и ингибирует клеточный апоптоз. Циклоспорин А назначается в дозе 5 мг/кг и вызывает гематологическое улучшение у 60больных этой группы (полные ремиссии развиваются реже, частичное улучшение – чаще).
Для лечения форм МДС РА, РАКС, РЦМД в качестве первичного метода лечения у пожилых (старше 60 лет) больных с гипоплазией кроветворения или при резистентности к циклоспорину в настоящее время широко применяется спленэктомия с биопсией печении. Наряду с лечебным эффектом данный подход позволяет исключить другие причины развития дисплазии кроветворения. Как правил, спленэктомия позволяет добиться длительных перерывов в гемотрансфузиях, улучшить качество жизни больных.
Использование цитостатических препаратов при РАИБ-варианте МДС в настоящее время считается самым эффективным лечением. До недавнего времени в качестве патогенетической терапии применяли в основном малые дозы цитозара и мелфалан. Схема лечения малыми дозами цитозара выглядит следующим образом. Вводят подкожно по 10 мг/м 2 2 раза в день в течение 14, 21 или 28 дней в зависимости от количества бластов и клеточности костного мозга. Мельфалан применяют в дозах 5 – 10 мг/м 2 в течение 5 дней peros . Такие курсы проводят раз в месяц, как правило, отполугода до 3 лет, с оценкой терапевтического эффекта каждые 2 – 4 месяца. Эффективной терапия считается при нормализации или относительной нормализации показателей периферической крови и костного мозга, при отсутствии или резком снижении зависимости от гемотрансфузий. Использование указанных схем лечения приводит к развитию частичной ремиссии у 56% больных. Однако, на выживаемость больных такая терапия существенно не влияет.
При тяжелом состоянии больных и невозможности проведения адекватной терапии при МДС-РАИБ-1 и -2 возможно назначать 6-меркаптопурин по 60 мг/м 2 в сутки peros в течение 3 лет.
В настоящее время делаются попытки использовать в лечении МДС талидомида и его аналога леналидомида, лишенного нейтротоксической активности, но являющегося мощным ингибитором протеаз. Применение леналидомида вызвало снижение трансфузионной зависимости у 67% больных, причем у 58% достигалась полная независимость от трансфузионной терапии. Стоит отметить, что этот препарат особенно эффективен при 5 q -варианте МДС, где его эффективность равна 91%, тогда как при других нарушениях кариотипа – только 19%.
У молодых больных до 60 лет в стандарты лечения МДС-РАИБ-2 входит полихимиотерапия. Используют курсы, применяемые в лечении острых миелобластных лейкозах: «7 + 3» и « FLAG ». «7 + 3»: цитарабин 100 мг/м 2 в/в капельно каждые 12 часов 1 – 7 дни курса и идарубицин 12 мг/м 2 в/в капельно 1 – 3 дни курса. « FLAG »: флударабин 25 мг/м 2 в/в капельно 1 – 5 дни курса, цитарабин 2 г/м 2 в/в капельно 1 – 5 дни курса + Г-КСФ (гранулоцитарный колониестимулирующий фактор) 5 мкг/кг п/к ежедневно до выхода из цитопении.
Из других активно разрабатываемых препаратов в гематологической практике заслуживают внимание триоксид мышьяка, бевацизумаб (авастин) и др.
В последнее время в клиническую практику внедрены современные цитостатические препараты ингибиторы ДНК-метилтрансфераз. Механизм их действия связан с ингибированием процесса метилирования ДНК в клетках опухолевого клона, что приводит к повышению активности генов, регулирующих клеточный цикл и нормализации процессов дифференцировки клеток костного мозга. Два основных вещества зарегестрированы в России под названием децитабин (Дакоген), азацитидин (Ведаза). По опубликованным данным крупнейших международных исследований эффективность использования этих препаратов в лечении МДС составила 50 – 70%. Децитабин вводят в дозе 20 мг/м 2 в/в капельно 1 – 5 дни раз в месяц. Таких курсов проводят4, далее оценивают эффект. При положительной оценке продолжают терапию в течение долгого времени до развития осложнений, при отсутствии эффекта используют другие препараты. Азацитидин вводят подкожно 75 мг/м 2 1 – 7 дни раз в месяц. Оценивают эффект через полгода, далее или продолжают терапию длительно или меняют препараты.
Необходимо знать, что самым серьезным осложнением химиотерапии, требующим иногда отмены лечения, является цитопения. Цитопения, как правило, проявляется снижением всех показателей крови ( Hb , лейкоциты и тромбоциты). Тяжелыми состояниями, угрожающими жизни считается анемия менее 70 г/л, тромбоцитопения менее 20 х 10 9 /л, лейкопения менее 1 х 10 9 /л или нейтропения менее 0,5 х 10 9 /л. Такие состояния требуют обязательного стационарного лечения, проведения трансфузионной и антибактериальной терапии.
Единственным радикальным методом лечения МДС могла бы стать аллогенная трансплантация костного мозга, однако, применение этого метода ограничивается пожилым возрастом больных, подавляющее большинство которых старше 60 лет.
Прогноз при МДС остается неблагоприятным и зависит от варианта МДС. При РА трансформация в острый лейкоз наблюдается у 15% больных, а медиана выживаемости составляет 50 месяцев. При РАКС эти показатели составляют соответственно 8% и 51 месяц; при РАИБ – 44% и 11 месяцев.
МИЕЛОДИСПЛАСТИЧЕСКИЕ СИНДРОМЫ:
механизмы развития, симптомы, лечение
Что такое МДС?
Миелодиспластические синдромы (МДС) представляют собой группу заболеваний с первичным поражением костного мозга, проявляющихся в том, что костный мозг не вырабатывает достаточного количества здоровых клеток крови.
Миелодиспластическими синдромами страдают, главным образом, пожилые люди (возраст большинства больных от 60 до 85 лет), однако ими могут заболеть и люди более молодого возраста (от 30 лет). По типам МДС различаются на первичные (идиопатические) – 80-90% случаев, вторичные (вследствие предшествующей химиотерапии и др. факторов) – 10-20%. Спорадические, фамильные – редко встречаются, но в этом случае надо исключать анемию Фанкони или др. варианты фенотипа с мутаторными генами. 5-летняя выживаемость при МДС не превышает 60%.
За небольшими исключениями, причины возникновения МДС неизвестны. У некоторых людей описан врожденный МДС. Если такой внешний фактор установить невозможно, то заболевание называют «первичным МДС».
Факторами риска первичного МДС считаются контакт с токсинами (бензин, органические растворители, пестициды), ионизирующее излучение, курение, врожденные и наследственные заболевания (анемия Фанкони, тяжелая врожденная нейтропения, синдром Швахмана-Даймонда, анемия Даймонда-Блэкфана), пожилой возраст. Вторичный МДС может развиваться после предшествующей химиотерапии онкологического заболевания (лимфома Ходжкина, рак молочной железы и др.) или после трансплантации клеток крови в результате мутагенного воздействия ряда лекарственных препаратов (мехлоретамин, прокарбазин, хлорамбуцил и др.).
Убедительных данных, свидетельствующих о том, что МДС могут вызывать какие-либо вирусы, отсутствуют, поэтому МДС не может передаваться окружающим людям. Поскольку члены семьи не находятся в группе повышенного риска, они не должны проходить дополнительное обследование.
МДС развивается в результате нарушения нормальной деятельности костного мозга.
Основной функцией костного мозга является выработка клеток крови, к которым относятся эритроциты, тромбоциты и лейкоциты. Каждая из этих клеток после выхода из костного мозга выполняет важные, сохраняющие жизнь, функции. От них зависит обеспечение тканей и органов кислородом (эритроциты), остановка кровотечения (тромбоциты) и защита от инфекций (лейкоциты). В здоровом костном мозге находятся незрелые клетки крови, называемые стволовыми клеткам или клетками-предшественниками которые, по мере необходимости превращаются в зрелые эритроциты, лейкоциты и тромбоциты, выполняющие свои функции.
При МДС эти стволовые клетки могут не достигать зрелости и (или) иметь сокращенный жизненный цикл, погибая в костном мозге до своего выхода в кровь, что приводит к уменьшению количества зрелых циркулирующих клеток крови (так называемая цитопения) и, соответственно, снижению их функции. Кроме того, зрелые клетки крови, циркулирующие в периферической крови, могут неправильно функционировать из-за, так называемой, дисплазии - аномалиях формы или морфологии клеток крови, находящихся в костном мозге и/или периферической крови.
Неспособность костного мозга вырабатывать здоровые зрелые клетки возникает постепенно, а потому пациенты могут длительно страдать от последствий заболевания, таких как анемия, кровоточивость и сниженная сопротивляемость инфекциям. Кроме того, у 30% пациентов МДС может развиваться острый миелоидный лейкоз (ОМЛ).
Клинические проявления МДС
Многие больные на ранних стадиях заболевания не испытывают никаких симптомов, т.к. в крови находится достаточное количество зрелых клеток. Одним из самых характерных симптомов в начале болезни является анемия (пониженное количество эритроцитов, гемоглобина и гематокрита).
Больные, страдающие анемией, обычно испытывают постоянное чувство усталости, слабость, снижение работоспособности, неспособность к концентрации внимания. Лучше переносят анемию женщины, чем мужчины. По мере нарастания анемии присоединяется учащение сердцебиения, затруднение дыхания, сонливость, головокружение. Возможно развитие обмороков. Особенно тяжело анемию переносят пожилые пациенты и люди с заболеваниями сердца и легких: у них может развиться стенокардия (боли в области сердца), инфаркт миокарда, нарасти одышка, снизиться переносимость физических нагрузок, могут развиться нарушения ритма сердца.
При поражении сосудов нижних конечностей усиливаются проявления так называемой перемежающей хромоты (появления болей в ногах при ходьбе на небольшие расстояния). Поэтому часто об изменениях в анализах крови узнают во время обследования по поводу терапевтической патологии .
Часто больные проходят лечение анемии под наблюдением терапевта, который использует с этой целью препараты железа, витамин В12, фолиевую кислоту, но не достигает успеха, т.е. анемия является «рефрактерной» (устойчивой) к этим стандартно применяемым препаратам, что может послужить поводом для консультации врача-гематолога.
Анемия может сопровождаться снижением количества нейтрофилов (нейтропения) и тромбоцитов (тромбоцитопения). Низкое количество лейкоцитов в крови (норма от 4000 до 10000 лейкоцитов в 1 микролитре крови) снижает сопротивляемость организма, прежде всего, к бактериальной инфекции. Больные нередко страдают рецидивирующими кожными инфекциями, инфекциями уха, горла и носа, бронхо-легочным инфекциям (бронхиты, пневмонии) и инфекциями мочевыводящих путей, полости рта (стоматиты) и зубов, сопровождаемые повышением температуры.
При тромбоцитопении (нормальное содержание в крови от 130000 до 450000 тромбоцитов в 1 микролитре крови) у больных отмечается повышенная кровоточивость со склонностью к образованию синяков и возникновение кровотечений даже в результате незначительных ударов и царапин. Для остановки кровотечения даже при небольших порезах может требоваться больше времени, чем обычно. Тяжелая тромбоцитопения, что наблюдается в редких случаях, наступает при уменьшении числа тромбоцитов ниже уровня 20 000 в 1 мкл или 20х10 9 /л и сопровождается кровотечениями.
Кровоподтеки могут быть значительными, некоторые размером с ладонь. Нередкими являются носовые кровотечения, и больные жалуются на кровоточивость десен, например, во время стоматологических процедур, а у женщин могут отмечаться более обильные менструальные кровотечения.
Пациенту с МДС рекомендуется консультироваться с врачом-гематологом прежде, чем обратиться за стоматологической помощью, учитывая риск возникновения кровотечений и инфекций. Более того, по показаниям могут быть назначены лекарственные препараты (профилактический прием антибиотиков, др.).
Диагностика МДС
1.Первым шагом в диагностике МДС является проведение клинического анализа крови путем взятия пробы крови из вены. В пробе крови определяется количество клеток крови (эритроцитов, лейкоцитов и их подтипов, а также тромбоцитов), форма и размер эритроцитов и лейкоцитов.
2. Для исключения наиболее часто встречающихся анемий проводят исследование сыворотки крови, где определяют уровень железа и ферритина (оценка запасов железа в организме), витамина В 12 и фолиевой кислоты, эритропоэтина (белок, который вырабатывается в почках в ответ на низкий уровень содержания кислорода в тканях организма, стимулирует образование эритроцитов в костном мозге).
3.Если причина поражения костного мозга признается вероятной, показано проведение исследования костного мозга. Исследование костного мозга включает исследование аспирата костного мозга (анализ миелограммы, цитологическое исследование), получаемого путем взятия пробы жидкого костного мозга, и трепанобиоптата костного мозга (пробы костной составляющей костного мозга).
В процессе исследования костного мозга определяются:
1) процентное содержание бластов и клеток с признаками дисплазии;
3) хромосомные аномалии, как например, отсутствующие или дополнительные хромосомы в клетках костного мозга. Любые аномалии описываются в отчете о результатах гематологического исследования, а хромосомные аномалии (отсутствие или делеция хромосом, а также наличие измененных или дополнительных хромосом или частей хромосом) включаются в отчет о результатах цитогенетического исследования. В дальнейшем у больных МДС проводятся повторные исследования костного мозга для того, чтобы определить клинический статус МДС с течением времени (ремиссия, стабилизация, прогрессия) и оценить эффект проводимой терапии.
Определение степени тяжести МДС у человека.
На основании полученной информации не только устанавливается диагноз МДС, но и определяется подтип болезни и прогноз течения у конкретного пациента. Для этого разработаны различные системы классификации. Согласно последней из предложенных классификаций, известной под названием «Классификация Всемирной организации здравоохранения (ВОЗ)», существует шесть различных подтипов МДС, разделение которых основано на анализе крупных международных баз данных и на лучшем понимании процессов течения болезни.
В прошлом широко применялась франко-американо-британская система классификации (ФАБ-классификация). Некоторые гематологи продолжают пользоваться этой системой и в настоящее время.
ФАБ-классификация была разработана в начале 80-х годов прошлого века группой врачей из Франции, Соединенных Штатов Америки и Великобритании, специализировавшихся на диагностике МДС. Основным критерием в данной классификации являлось процентное содержание бластных клеток в костном мозге, при этом процентное содержание этих клеток менее 2% считалось нормальным для здорового костного мозга. Согласно ФАБ-классификации различаются следующие пять подтипов МДС:
· рефрактерная анемия (РА);
· рефрактерная анемия с кольцевыми сидеробластами (РАКС);
· рефрактерная анемия с избытком бластов (РАИБ);
· рефрактерная анемия с избытком бластов в трансформации (РАИБ-Т);
· хронический миеломоноцитарный лейкоз (ХММЛ).
Система классификации ВОЗ для МДС у взрослых больных сохраняет некоторые элементы системы ФАБ-классификации и расширяет категории подтипов МДС. Основные характеристики шести подтипов МДС, различаемых системой классификации ВОЗ, освещены в приведенной ниже таблице.
Заслуживающие внимания изменения в системе классификации ВОЗ, по сравнению с системой ФАБ-классификации, заключаются в следующем:
· разделение подтипа РАИБ на два подтипа;
· исключение ХММЛ как самостоятельного подтипа;
· включение МДС с хромосомной аномалией «синдром 5 q -» как отдельного подтипа;
· исключение подтипа рефрактерная анемия с избытком бластов в трансформации (РАИБ-Т), который в настоящее время рассматривается как подлежащий включению в ОМЛ;
· введение категории «МДС неклассифицируемый».
Рефрактерная анемия (РА). Больные этой категории страдают анемией, которая не отвечает на лечение препаратами железа или витаминами, то есть является рефрактерной по отношению к такому лечению. Анемия может сопровождаться тромбоцитопенией и нейтропенией легкой или средней тяжести.
Рефрактерная анемия с кольцевыми сидеробластами (РАКС). У больных с данным видом анемии отмечается дисплазия только в эритроидном ряду. Сидеробласты – это клетки эритроидного ряда, содержащие гранулы железа; кольцевые сидеробласты являются аномальными. Рефрактерная анемия с кольцевыми сидеробластами или без них (РАКС) считается наиболее доброкачественным подтипом в системе классификации ВОЗ.
Рефрактерная цитопения с мультилинейной дисплазией (РЦМД). В эту категорию включаются больные, страдающие рефрактерной цитопенией (устойчивым низким количеством клеток крови какого-либо типа, например, рефрактерной нейтропенией или рефрактерной тромбоцитопенией) и имеющие минимальную дисплазию, по меньшей мере, в двух типах клеток крови, а также количество бластов 5% и менее, либо количество кольцевых сидеробластов менее 15%. Если количество кольцевых сидеробластов у больного с РЦМД превышает 15%, ставится диагноз РСМД-КС.
|
ВОЗ-классификация МДС |
|
|
Подтип МДС |
Характеристика |
|
РА |
Минимальная дисплазия в одном типе клеток крови (красных кровяных тельцах или эритроцитах) и < 5% бластов в костном мозге |
|
РАКС |
Дисплазия только эритроидного ростка и > 15% кольцевых сидеробластов |
|
РЦМД |
Дисплазия (> 10%) в двух или трех типах клеток крови, < 5% бластов и < 15% кольцевых сидеробластов в костном мозге (количество кольцевых сидеробластов > 15% называется РЦМД-КС) |
|
РАИБ |
|
|
РАИБ 1 |
Количество бластов в костном мозге от 5% до 9% |
|
РАИБ 2 |
Количество бластов в костном мозге от 10% до 19% |
|
МДС/МПЗ |
Дисплазия при наличии характеристик, обычно присущих миелопролиферативному заболеванию; включает ХММЛ |
|
Синдром 5 q - |
Больные, у которых отсутствуют хромосомные аномалии, за исключением делеции в длинном плече 5-й хромосомы |
|
МДС неклассифицируемый |
Включает больных с цитопенией в одном типе клеток крови, кроме анемии (то есть, с нейтропенией или тромбопенией) и какими-либо необычными характеристиками (например, фиброзом костного мозга) |
Рефрактерная анемия с избытком бластов (РАИБ). Эта категория делится на две подкатегории, которые различаются количеством бластов в костном мозге. У больных, имеющих РАИБ-1, количество бластов составляет от 5% до 9%, а у больных с РАИБ-2 – от 10% до 19%.
Миелодиспластический синдром/миелопролиферативное заболевание (МДС/МПЗ). Больные с МДС/МПЗ включают тех, которые страдают хроническим миеломоноцитарным лейкозом (ХММЛ), который является отдельной категорией в системе ФАБ-классификации.
5 q - (5 q минус) синдром. Синдром 5 q -, в настоящее время выделяемый в отдельный подтип МДС, впервые был описан более 30 лет тому назад. Название этого синдрома связано с хромосомой номер 5, а именно с хромосомной аномалией (делецией) в длинном плече ( q ) хромосомы 5. Делеция в пределах длинного плеча хромосомы N о 5 является единственной хромосомной аномалией у больных МДС с диагнозом «синдром 5 q -».
Обычно этот синдром наблюдается у женщин среднего возраста, как правило, в возрасте 65 лет, и сопровождается анемией легкой или средней тяжести, низким количеством лейкоцитов (лейкопения) и зачастую нормальным или повышенным количеством тромбоцитов. Синдром 5 q - характеризуется благоприятным прогнозом, длительностью жизни более пяти лет со времени постановки диагноза (критерий, принятый в медицине для оценки тяжести заболевания).
Неклассифицируемый МДС. Данная категория включает больных с цитопенией в одном типе клеток крови (например, тромбопенией или нейтропенией) и какими-либо необычными характеристиками (например, фиброзом костного мозга), не более 1%- 2% всех случаев МДС.
Еще одной системой, используемой для характеристики активности МДС и составления прогноза для пациента, является Международная прогностическая балльная система ( IPSS ).
Для оценки степени тяжести МДС используется Международная прогностическая балльная система ( IPSS ), заболевание оценивается в баллах, исходя из опасности, которую оно представляет для больного, то есть времени вероятного прогрессирования болезни или ее трансформации в ОМЛ. Прогностический балл определяется на основании процентного содержания бластов, присутствующих в костном мозге, результатов цитогенетического исследования, а также показателей количества клеток крови и других результатов анализа крови.
Прогностический балл определяется путем сложения индивидуальных балов по процентному содержанию бластов, по результатам цитогенетического исследования и анализов крови и используется для оценки исхода болезни для больного МДС. Прогностический балл показывает, к какой из групп риска относится больной.
|
Определение прогностического балла Прогностический балл: сумма индивидуальных баллов по бластам, результатам цитогенетического исследования и результатам анализа крови |
|
|
Процентное содержание бластов в костном мозге |
Балл |
|
5% и менее |
|
|
5-10% |
|
|
11-20% |
|
|
21-30% * |
2 , 0 |
|
Результаты цитогенетического исследования ** |
|
|
хорошие |
|
|
промежуточные |
|
|
плохие |
|
|
Уровень цитопений по результатам анализа крови *** |
|
|
0 или 1 цитопении |
|
|
2 или 3 цитопении |
|
|
* Больным, в костном мозге которых содержится более 20% бластов, устанавливают диагноз острого миелоидного лейкоза (ОМЛ). ** Прогностически хорошие результаты означают нормальный набор из 23 пар хромосом или набор, в котором имеется только частичная потеря длинного плеча хромосомы N о 5. К промежуточным относятся все результаты, которые не попадают под определение «хорошие» или «плохие». Прогностически плохие результаты включают потерю одной из двух хромосом N о 7 (моносомия 7), добавление третьей хромосомы N о 8 (трисомия 8), либо три и более аномалий. *** Уровень цитопений по результатам анализа крови определяется следующим образом: нейтрофилы < 1,800 на 1 микролитр крови; гематокрит < 36% эритроцитов в общем объеме крови в организме; тромбоциты < 100,000 на 1 микролитр крови. |
|
Лечение МДС
Целями лечения являются восстановление показателей периферической крови, уменьшение клинических проявлений МДС, снижение зависимости от переливаний компонентов крови, отсрочка трансформации в ОМЛ, увеличение продолжительности жизни, улучшение качества жизни пациентов.
Методы лечения пациентов с МДС зависят от типа заболевания, прогностических факторов, возраста больного, а также сопутствующей патологии и могут подразделяться на потенциально излечивающие терапевтические методы и поддерживающую терапию.
Поддерживающая и симптоматическая терапия
Основу лечения МДС составляет поддерживающая терапия, которая включает применение ростовых факторов, лечение интеркуррентных инфекций и заместительную терапию компонентами крови.
Одним из аспектов поддерживающей терапии пациентов с МДС является применение гемопоэтических ростовых факторов, которые воздействуют на костный мозг, усиливая продукцию одного или нескольких ростков кроветворения. В последние годы появилось несколько человеческих рекомбинантных ростовых факторов, включающих эритропоэтины (ЭПО: эпоэтины α и β, дарбепоэтин), гарнулоцитарные и гранулоцитарно-макрофагальные колониестимулирующие факторы (Г-КСФ и ГМ-КСФ: филграстим, молграмостим), агонисты тромбопоэтиновых рецепторов (ромиплостим, элтромбопаг), которые стимулируют выработку эритроцитов, гранулоцитов и тромбоцитов соответственно. На лечение ростовыми факторами, приводящее к снижению необходимости в заместительной терапии, отвечают только 20-30% пациентов с МДС. Прогностическими факторами ответа на терапию являются исходный уровень ЭПО, выраженность трансфузионной потребности, длительность заболевания, тип заболевания по классификации FAB или ВОЗ, группа риса по шкале IPSS .
Несмотря на то, что стоимость терапии гемопоэтическими факторами роста в 3-4 раза превышает стоимость трансфузионной терапии, первая остается предпочтительным видом лечения. Успешное лечение гемопоэтическими ростовыми факторами позволяет избежать или, в некоторых случаях, снизить потребность в многократных трансфузиях компонентов крови и сопутствующий риск перегрузки железом.
В основе поддерживающей терапии пациентов с МДС лежит заместительная терапия компонентами крови. У пациентов с низким риском развития ОМЛ анемия может быть основной клинически значимой проблемой. Заместительная терапия облегчает симптомы анемии и, следовательно, является важным методом лечения. Частота переливаний зависит от состояния больного, тяжести анемии, а также сопутствующей патологии. Некоторые больные могут нуждаться в переливаниях эритроцитарной массы каждые одну-две недели, в то время как другим может быть достаточно всего лишь одного переливания каждые шесть-двенадцать недель. Результатом заместительной терапии является повышение уровня гемоглобина, которое, как показывают исследования, имеет положительную корреляцию с показателем качества жизни. Переливание тромбоцитарной массы проводятся редко и только в тех случаях, когда количество тромбоцитов крайне низкое и/или имеются опасные для жизни кровотечения. Однако преимущества трансфузионной терапии следует сопоставлять с риском инфекционных осложнений, иммунологических побочных эффектов, а также перегрузки организма пациента железом.
Накопление в организме избыточного железа представляет собой серьезную клиническую проблему, которая, если ее не решать, может привести к повреждению органов. Повторные переливания эритроцитов, содержащих железо в составе гемоглобина, приводят к депонированию избытка железа в клетках ретикулоэндотелиальной системы, прежде всего в печени, селезенке, железах внутренней секреции и сердце, а также в небольшом количестве в тканях мозга или скелетных мышцах. Поэтому главными осложнениями перегрузки железом являются заболевания сердца, печени и эндокринные нарушения. С целью профилактики перегрузки организма железом используется лабораторный контроль за его запасами (ферритин сыворотки), а также препараты, которые хелатируют, или связывают железо, способствуют его выводу из организма.
В настоящее время имеются два препарата для борьбы с перенасыщением железом у больных, зависящих от переливания крови - дефероксамин и деферасирокс.
Препарат дефероксамин (Десферал) задерживает токсическое действие накопления избыточного количества железа в организме. Он назначается в дополнение к переливанию крови и вводится посредством инъекции обычно 3-7 раз в неделю. Некоторые больные получают подкожные инъекции препарата 2 раза в день. Препарат деферасирокс (Эксиджад), хелатор, принимается перорально. Лечение этими препаратами следует начинать пациентам, получившим 20-30 единиц донорских эритроцитов, которым предстоит постоянная трансфузионная терапия, а также пациентам с уровнем ферритина сыворотки крови, постоянно превышающим 1000 мкг/л.
Потенциально излечивающие терапевтические методы
Для контроля над симптомами болезни или излечения МДС у молодых пациентов МДС высокого риска применяют интенсивную химиотерапию, чтобы максимально уничтожить клон патологических клеток и достигнуть длительной ремиссии.
Пациентам моложе 55 лет с МДС высокого или промежуточного 2 риска по шкале IPSS , не имеющим возможности трансплантации стволовых клеток, может подойти химиотерапия аналогичная той, что применяется для лечения ОМЛ. Данный метод лечения имеет значительные побочные эффекты, такие как выпадение волос, появление стоматита ротовой полости, тошнота, рвота, появление жидкого стула. Кроме этих побочных явлений, химиотерапия оказывает неблагоприятное воздействие на здоровые клетки наряду с клетками, подвергшимися диспластическим воздействиям, что требует длительного пребывания в условиях гематологического отделения. В это время пациенту производятся переливания эритроцитарной и тромбоцитарной массы, назначаются антибактериальные препараты для борьбы с инфекцией. Если индукционная химиотерапия обеспечивает адекватный контроль над патологическими клетками (состояние ремиссии), то восстановление нормальных клеток крови должно начаться в течение нескольких недель. К сожалению, вероятность контроля МДС с помощью индукционной химиотерапии составляет около 30%. Даже в случаях успешного лечения болезнь может возвращаться - рецидивировать.
1. Единственным известным методом лечения, способным излечить МДС, является трансплантация аллогенных (донорских) гемопоэтических стволовых клеток. Следует иметь в виду, что это сложная процедура, связанная с риском ранних и поздних осложнений. Исход лечения зависит от степени совместимости ( HLA -совместимости) донора и пациента (реципиента), а также от доступности подходящих донорских клеток (наличие совместимых кровных братьев и/или сестер, доступность банка доноров). Таким образом, есть строгие показания и противопоказания для данного вида лечения: оно подходит для тех случаев, когда пациенты в состоянии перенести трансплантацию стволовых клеток и имеют подходящего донора. Недавно предложенные методы трансплантации с режимами кондиционирования пониженной интенсивности имели определенный успех у пациентов с МДС старше 55 лет. Исследования в этой области продолжаются.
2. Участие иммунных механизмов в развитии патологии костного мозга при МДС стало причиной разработки методов лечения с применением иммуносупрессоров. Из этой группы препаратов в лечении МДС используются антитимоцитарный глобулин (АТГ) и антилимфоцитарный глобулин (АЛГ) и циклоспорин А. Лечение АЛГ/АТГ более эффективно у пациентов молодого возраста с наличием антигена HLA - DR 15, получавших трансфузии эритроцитов в течение непродолжительного времени. Такое лечение позволяет добиться независимости от переливаний эритроцитов у 33% пациентов; у 56% пациентов с тяжелой тромбоцитопенией наблюдалось значительное повышение уровня тромбоцитов, а у 44% пациентов с нейтропенией уровень нейтрофилов повысился более 1х10 9 /л. Циклоспорин А оказался наиболее эффективным у пациентов, имеющих менее 5% бластных клеток в костном мозге, нормальный кариотип, гипоклеточный костный мозг и скопления лимфоидных клеток в трепанобиоптате.
3. Изучение механизмов развития МДС, предпринятое в последние годы показало, что для данной патологии характерно гиперметилирование промоторной области некоторых генов-онкосупрессоров, что приводит к «молчанию» этих генов и пролиферации опухолевых клеток и трансформации в ОМЛ. На основе этих знаний были разработаны так называемые гипометилирующие агенты, которые содействуют гипометилированию ДНК, вызывая экспрессию ранее «выключенных» генов.
В мае 2004 года Управление США по контролю за продуктами питания и лекарственными препаратами ( Food and Drug Administranion , FDA ) выдало разрешение на применение инъекционного препарата азацитидин (Вайдаза) для лечения всех типов МДС. В РФ препарат был одобрен к применению в 2010 году для лечения МДС, ОМЛ И ХММЛ. Результаты исследования показали, что азацитидин достоверно продлевает жизнь пациентам с миелодиспластическим синдромом (МДС) промежуточного и высокого риска, а также с острым миелоидным лейкозом 20-30% бластов (ранее относился к МДС высокого риска), которым не показана трансплантация стволовых клеток/интенсивная химиотерапия.
Согласно принятым в России протоколам, лечение пациентов МДС промежуточного-2/высокого риска и ОМЛ, которые не подходят для интенсивной химиотерапии, осуществляется низкими дозами цитарабина и/или с помощью поддерживающей терапии. Такое лечение позволяет облегчить симптомы болезни, улучшить качество жизни пациентов, но не имеет других существенных преимуществ в сравнении с естественным течением болезни. В то же время продолжительность жизни пациентов с МДС высокого риска, получающих азацитидин, увеличивается в 3 раза по сравнению с принятым лечением. При этом различия группы азацитидина с группами поддерживающей терапии и низких доз цитарабина статистически достоверны (р=0,045), независимо от возраста или кариотипа (анализ данных исследования III фазы AZA -001)
Азацитидин увеличивает количество больных МДС, не нуждающихся в гемотрансфузиях, в 4 раза. Кроме того, азацитидин показан в качестве временной терапии у пациентов, ожидающих донора для трансплантации (рекомендации по терапии МДС, NCCN , 2010).
К нежелательным явлениям 3-4 степени, развивающимся на фоне лечения азацитидином, относятся гематологические (71.4%), включая тромбоцитопению (85%), нейтропению (91%) и анемию (57%). Фебрильная нейтропения встречалась у 8.0% пациентов, крайне редко (<2%) регистрировались нейтропенический сепсис, пневмония, тромбоцитопения и геморрагические нежелательные явления.
Азацитидин вводится подкожно 75 мг/м 2 1 р/день 7 дней через 21 день (цикл), не менее 6 циклов. Он имеет благоприятный профиль безопасности и может применяться амбулаторно.
В мае 2006 года комитет FDA одобрил применение для лечения всех подтипов МДС еще одного гипометилирующего препарата – децитабина (Дакогена). К применению для лечения МДС в РФ препарат был одобрен в 2006 году.
В открытом рандомизированном исследовании III фазы с участием 170 пациентов, сравнивавших децитабин с поддерживающей терапией, частота достижения ремиссии составила 17%, гематологическое улучшение было отмечено еще у 13% пациентов. Децитабина уменьшает риск трансформации в лейкоз и у пациентов, которые достигают ответа, увеличивает выживаемость. Вероятность трансформации в острый миелоидный лейкоз или смерти была в 1,68 раза выше в группе поддерживающей терапии по сравнению с группой с применением децитабина.
При проведении терапии децитабином наиболее частыми были следующие побочные эффекты: нейтропения-90%, тромбоцитопения-89%, анемия-82%, лихорадка -53%, тошнота-42%.
Децитабин вводится внутривенно (15 мг/м2 путем 3-часовой внутривенной инфузии каждые 8 часов в течение 3 последовательных дней каждые 6 недель на протяжении 10 циклов).
Терапия как азацитидином, так и децитабином должна проходить под контролем врача-гематолога, имеющего опыт лечения больных МДС и ОМЛ.
4. В декабре 2005 года FDA США одобрило применение иммуномодулирующего препарата леналидомид для лечения пациентов из группы низкого или промежуточного -1 риска с МДС, в том числе с del (5 q ). Препарат применяется перорально в капсулах, обладает иммуномодулирующим, антиангиогенным и противоопухолевым эффектом. Вместе с этим у него отсутствует нейротоксичность, свойственная другим препаратам из данной химической группы. Частота достижения ремиссии на фоне лечения леналидомидом составила 83% у пациентов с клональной интерстициальной делецией хромосомы 5 q 31.1, в то время как у пациентов с нормальным кариотипом частота достижения ремиссии составила 57%, а у пациентов с другими аномалиями кариотипа – 12%. В исследовании II фазы с участием 146 пациентов с МДС низкого или промежуточного 1 риска с del (5 q 31), нуждающихся в постоянной трансфузионной терапии, 64% пациентов перестали нуждаться в трансфузиях. Частота достижения трансфузионной независимости была выше среди пациентов с изолированной del (5 q ) (69%), чем у остальных пациентов (49%; Р=0,003).
В феврале 2012 файл по леналидомиду был принят в Европейском Медицинском Агентстве для регистрации этого показания – «для лечения пациентов с МДС низкого/промежуточного-1 риска, вариант трансфузионно зависимой анемии с del (5 q ) с/без других цитогенетических аномалий» .
Таким образом, миелодиспластические синдромы (МДС) представляют собой гетерогенную группу заболеваний костного мозга, для которых характерен неэффективный гемопоэз и различная степень риска трансформации в острый лейкоз. Диагностика МДС может представлять трудность, ввиду наличия у них общих черт с другими гематологическими заболеваниями, включая ОМЛ, апластическую анемию и наследственную сидеробластную анемию. Исследования, направленные на раскрытие механизмов болезни, которые ведут к возникновению МДС, помогают нам лучше понять МДС. Не менее важным является то, что лучшее понимание механизмов болезни ведет к созданию новых препаратов для лечения различных подтипов МДС у больных, относящихся к различным группам риска.
Лишь недавно лечение МДС вышло за рамки поддерживающей терапии, проводившейся с целью облегчения симптомов. Единственным потенциально излечивающим методом терапии МДС является аллогенная трансплантация гемопоэтических клеток, которая, однако, возможна не во всех случаях.
В последние годы на основе изучения патогенеза данной патологии разрабатывается большое количество лекарственных препаратов, часть из которых найдет свое место в лечении МДС. В качестве примеров можно привести ингибитор ангиогенеза бевацизумаб (Авастин), ингибитор цитокинов инфликсимаб (Ремикейд), ингибиторы деацетилазы, гистонов -вальпроевая кислота и вориностат, многие другие. Научные данные позволяют полагать, что комбинированная терапия препаратами с различными механизмами действия приведет к искомой эффективности лечения.
Но, какая бы терапевтическая стратегия в конечном итоге не выбиралась, в ней должны учитываться решение пациента.
Миелодиспластический синдром (МДС ) – группа гематологических заболеваний, обусловленных нарушением работы костного мозга по воспроизведению одного или более типов клеток крови: тромбоцитов, лейкоцитов, эритроцитов. У людей, страдающих МДС, костный мозг, компенсируя естественный процесс уничтожения клеток крови селезенкой, не в состоянии воспроизвести их в нужном количестве. Это приводит к увеличению риска инфекций, кровоточивости и анемии, которая также проявляется усталостью, одышкой или сердечной недостаточностью. Развитие МДС может носить как спонтанный характер (без видимых причин), так и быть обусловленным использованием химиопрепаратов, облучения. Последний вариант МДС часто называют «вторичным», и хотя встречается он гораздо реже, хуже поддается лечению. Подавляющее большинство случае «первичного» МДС развивается у людей старше 60 лет, в детском возрасте болезнь встречается редко.
Клиническая картина МДС
В подавляющем большинстве пациенты обращаются за помощью с жалобами на усталость, утомляемость, одышку при физической нагрузке, головокружения – симптомами, связанными с развитием анемии. Остальным же пациентам диагноз устанавливается случайно, при лабораторном тестировании анализов крови, сделанных по другим причинам. Реже диагноз устанавливается при лечении инфекции, геморрагического синдрома, тромбоза. Такие признаки, как потеря веса, немотивированная лихорадка, болевой синдром, также могут быть манифестацией МДС.
Диагноз МДС
Диагностика МДС базируется, прежде всего, на лабораторных данных, которые включают:
- полный клинический анализ крови;
- цитологическое и гистологическое исследования костного мозга;
- цитогенетический анализ периферической крови или костного мозга для выявления хромосомных изменений.
Обязательные диагностические мероприятия при МДС
В обязательный перечень диагностических мероприятий входят:
- Каждому пациенту должно быть проведено морфологическое исследование аспирата, взятого из костного мозга. Это требуется, однако, не является необходимым у пожилых пациентов, у которых установление диагноза МДС не изменяет тактику лечения или тяжесть состояния не позволяет провести исследование. Только на основании морфологического исследования диагноз МДС поставить невозможно – минимальные диагностические критерии не всегда ясны. Трудности возникают, потому что множество реактивных нарушений связано с дисплазией кроветворения, а умеренные диспластические изменения часто отмечаются у здоровых людей с нормальной кровью.
- Каждому пациенту должна быть выполнена трепанобиопсия костного мозга. Гистология костного мозга служит дополнением к уже полученной морфологической информации, следовательно, биопсия должна быть выполнена во всех случаях подозрения на МДС.
- У всех пациентов должен быть выполнен цитогенетический анализ.
Хромосомные нарушения подтверждают присутствие патологического клона и являются определяющими при решении вопроса о наличии МДС или реактивных изменений.
Классификация МДС основывается на количестве и типе бластных клеток, а также наличии хромосомных изменений, при этом тип МДС у пациента по мере развития заболевания может изменяться в сторону прогрессирования, вплоть до развития острого миелобластного лейкоза у 10% пациентов. Это система классификации используется ВОЗ.
Возможно, самая полезная система клинической классификации для МДС – Международная Прогностическая Система (IPSS). Эта модель была разработана для оценки таких переменных категорий как возраст, тип бластных клеток, генетические изменения. На основании этих критериев было выявлено 4 группы риска – низкий, промежуточный 1, промежуточный 2 и высокого риска.
Рекомендации по лечению основываются именно на отношении пациента к какой-либо из групп риска. Так пациент с низким уровнем риска может жить много лет прежде, чем потребуется лечение МДС, в то время как человек с промежуточным или высоким риском обычно нуждается в немедленном начале лечения.
Классификация МДС
Всемирная организация здравоохранения (ВОЗ), основываясь на уровнях доказательности, издала предложения о новой классификации МДС.
- Рефрактерная анемия (РА)
- Рефрактерная цитопения с мультилинейной дисплазией (РЦМД)
- Миелодиспластический синдром с изолированной del (5q)
- Миелодиспластический синдром неклассифицируемый (МДС-Н)
- Рефрактерная анемия с кольцевидными сидеробластами (РАКС)
- Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами (РЦМД-КС)
- Рефрактерная анемия с избытком бластов-1 (РАИБ-1)
- Рефрактерная анемия с избытком бластов-2 (РАИБ-2)
| Вариант | Изменения в периферической крови | Изменения в костном мозге |
|---|---|---|
| Рефрактерная анемия (РА) | Анемия, отсутствие бластов | Дисплазия эритроцитарного ростка, менее 5% бластов, менее 15% кольцевых сидеробластов |
| Рефрактерная цитопения с мультилинейной дисплазией (РЦМД) | Двухростковая цитопения или панцитопения, отсутствие бластов и палочек Ауэра, менее 1х10 9 моноцитов | Дисплазия более чем 10% клеток в двух и более ростках кроветворения, менее 5% бластов, отсутствие палочек Ауэра, менее 15% кольцевых сидеробластов |
| Миелодиспластический синдром с изолированной del (5q) | Анемия, менее 5% бластов, нормальное количество тромбоцитов | Менее 5% бластов, отсутствие палочек Ауэра, изолированная del (5q) |
| Миелодиспластический синдром неклассифицируемый (МДС-Н) | Цитопения, отсутствие бластов, отсутствие палочек Ауэра | Одноростковая дисплазия гранулоцитарного или мегакариоцитарного ростков, менее 5% бластов, отсутствие палочек Ауэра |
| Рефрактерная анемия с кольцевидными сидеробластами (РАКС) | Анемия, отсутствие бластов | Изолированная дисплазия эритроидного ростка, менее 5% бластов, более 15% кольцевых сидеробластов |
| Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами (РЦМД-КС) | Цитопения (бицитопения или панцитопения), отсутствие бластов и палочек Ауэра, менее 1х10 9 моноцитов | Дисплазия более чем 10% клеток в двух и более ростках кроветворения, менее 5% бластов, отсутствие палочек Ауэра, более 15% кольцевых сидеробластов |
| Рефрактерная анемия с избытком бластов-1 (РАИБ-1) | Цитопения, менее 5% бластов, отсутствие палочек Ауэра, менее 1х10 9 моноцитов | Дисплазия одного и более ростков кроветворения, 5-9% бластных клеток |
| Рефрактерная анемия с избытком бластов-2 (РАИБ-2) | Цитопения, 5-19% бластов, возможно наличие палочек Ауэра, менее 1х10 9 моноцитов | Дисплазия одного и более ростков кроветворения, 10-19% бластов, палочки Ауэра |
Лечение МДС
В настоящее время нет никакого иного способа радикального лечения МДС кроме пересадки костного мозга, хотя существует множество схем для контроля симптомов, осложнений и улучшения качества жизни.
- Высокоинтенсивная терапия требует стационарного лечения и включает интенсивную полихимиотерапию и трансплантацию стволовых клеток.
- Лечение низкой интенсивности включает методы, не требующие длительного стационарного лечения, проводящиеся в амбулаторных условиях или в условиях дневного стационара, – низкодозная химиотерапия, иммунодепрессивная, заместительная терапии.
- Пациенты моложе 61-летнего возраста с минимальными признаками и находящиеся в группе промежуточного риска 2 или высокого риска (ожидаемое выживание 0.3-1.8 года) требуют высокоинтенсивной терапии.
- Пациенты низкой или промежуточной 1 категории (ожидаемое выживание 5-12 лет) лечатся терапией с низкой интенсивностью.
- Пациенты моложе 60-летнего возраста с хорошим статусом и ожидаемым выживанием между 0.4 и 5 годами обычно лечатся схемами низкой интенсивности, хотя могут рассматриваться как кандидаты для высокоинтенсивной терапии, включая трансплантацию.
- Для пациентов с ограниченным сроком жизни рекомендуются поддерживающая и симптоматическая терапии и/или методы лечения низкой интенсивности.
Лечение низкой интенсивности
Поддерживающая терапия является важной частью лечения, и учитывает, как правило, пожилой возраст пациентов, она включает симптоматическую терапию, направленную на поддержание уровня лейкоцитов, тромбоцитов, эритроцитов. Эта терапия призвана улучшить качество жизни и продлить её продолжительность.
- Трансфузия эритроцитарной массы необходима для купирования анемического синдрома. При необходимости неоднократных и массивных трансфузий возникает риск перегрузки железом, что требует использование хелатной терапии.
- Переливание тромбоцитов требуется для профилактики или купирования кровоточивости и, как правило, не ведёт к отдаленным осложнениям.
- Гемопоэтические ростовые факторы – белки, способствующие росту и развитию клеток крови, их использование позволяет сократить потребность в заместительных трансфузиях. Однако много пациентов с МДС не отвечают на ростовые факторы. Гранулоцитарный колониестимулирующий фактор (G-CSF) или гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) могут увеличивать количество нейтрофилов, однако терапия только ими одними не рекомендуется. Рекомбинантный эритропоэтин (EPO, Procrit ® , Epogen ®) способствует увеличению числа эритроцитов и уменьшает зависимость от гемотрансфузий приблизительно у 20% пациентов с МДС.
Комбинированная химиотерапия, используя G-CSF наряду с EPO, может быть более эффективной, чем использование одного только EPO, особенно у людей из низкой группы риска при пониженном фоновом уровне EPO в сыворотке.
Иммунодепрессивные препараты могут быть эффективны у пациентов с гипопластическим типом кроветворения. Некоторые из этих пациентов, особенно молодые с ранней стадией болезни и гипоплазией, отвечают на иммунодепрессивные методы лечения, которые противостоят иммунной атаке на костный мозг. Использование иммунодепрессивной терапии может позволить 50-60% пациентам с HLA DR2 типом ткани прекратить заместительную терапию.
Схемы иммунодепрессивных методов лечения включают антитимоцитарный глобулин (ATG) и циклоспорин. ATG обычно используется в качестве внутривенной инфузии один раз в день в течение 4 дней, в то время как циклоспорин обычно назначает перорально (приём таблеток) на длительное время, до развития тяжелых осложнений или прогрессирования МДС на фоне лечения. Наиболее частыми осложнениями терапии ATG можно считать сывороточную болезнь, купируемую назначение стероидных гормонов.
Производные талидомида – препарата, стимулирующего иммунную систему и его аналоги (Revlimid ® , lenalidomide), – успешно используются в лечении других гемобластозов (лимфомы, множественная миелома).
Lenalidomide особенно эффективен у пациентов с анемией из низкой или промежуточной 1 групп МДС с повреждением 5 хромосомы (синдром 5q минус).
Химиотерапия
Низкие дозы цитостатиков в монорежиме могут быть рекомендованы для людей с промежуточным или высоким риском, которые не являются кандидатами для высокодозной терапии в силу различных причин.
- Цитарабин – наиболее широко изученный препарат, хотя частота достижения полной ремиссии при его использовании ниже 20%.
- Децитабин (Dacogen ®) – современный, весьма эффективный препарат, использование которого сопряжено с высоким риском осложнений.
Терапия МДС высокой интенсивности
Пациенты с промежуточным или высоким риском при МДС подлежат терапии режимами химиотерапии аналогично используемым для лечения острого миелобластного лейкоза ОМЛ. Однако это лечение рекомендуется относительно молодым людям (моложе 60 лет), с хорошим жизненным статусом и при отсутствии HLA-идентичного донора. Этот тип лечения лучше не применять у лиц старше 60 лет, а также при низком жизненном статусе или большом числе цитогенетических нарушений, так как сопряжен с тяжелыми осложнениями.
У некоторых пациентов поддерживающая терапия может обеспечить тот же результат, что и химиотерапия, но с более низким риском осложнений или токсичности. Некоторые пациенты добиваются большего успеха при проведении только симптоматической терапии осложнений МДС (анемии, инфекции, кровоточивости), не пытаясь излечить саму болезнь.
Как ранее упоминалось, трансплантация стволовых клеток является единственным видом лечения, который может привести к длительной ремиссии. Однако осложнения терапии могут превалировать над возможным эффектом. В прошлом пациентов старше 50 лет не рассматривали как кандидатов для такого лечения. Достижения последних пятнадцати лет позволили отодвинуть возрастную планку до 60 лет и старше. Однако приблизительно 75% пациентов с МДС на момент установки диагноза уже старше 60 лет, таким образом, обычная трансплантация может быть предложена только малой части пациентов.
Трансплантация рекомендуется для людей с промежуточным 1, промежуточными 2 и высоким риском моложе 60 лет и наличием идентичного донора, но не для пациентов с низкой группой риска. Хотя есть существенный шанс на получение ремиссии у пациентов из группы риска (60%), весьма высоки (более 40%) связанные с пересадкой смертельные случаи и частота рецидивирования в течение 5 лет. Возможно использование неродственных доноров, но в этой ситуации возраст пациента является важным фактором в успехе лечения.
Использование режимов пониженной интенсивности при трансплантации расширяет категории пациентов, которым можно провести это лечение, но долгосрочные результаты еще нуждаются в оценке. Пока создается впечатления о повышенной частоте рецидивов по сравнению со стандартной подготовкой к трансплантации.
У пациентов с МДС средняя продолжительность жизни зависит от категории риска и возраста. Есть значительные вариации течения болезни от пациента к пациенту, особенно в группе низкого риска.
Руководитель отделения гематологии
Медицинского центра Банка России,
кандидат медицинских наук
Колганов Александр Викторович
руса в клетках костного мозга с помощью ПЦР и иммуногистохими ческого исследования трепанобиоптата.
25. Компьютерная томография (КТ) брюшной полости и грудной клетки.
26. Колоноскопия.
27. Определение мутаций в генах гемохроматоза.
28. Определение маркеров тромбофилии.
29. Определение мутаций в гене тирозинкиназы Jak2 и генов PDJFRa/b .
2. Дифференциальный диагноз
Дифференциальный диагноз проводится с мегалобластными анемия ми, апластической анемией, пароксизмальной ночной гемоглобинурией, аутоиммунной гемолитической анемией с синдромом Фишера-Эванса, острым эритромиелозом, хроническим активным гепатитом, системной красной волчанкой, эритропоэтической формой сидеробластной анемии, лимфопролиферативными заболеваниями, аутоиммунными тиреоидита ми, милиарным туберкулезом, малярией, лейшманиозом, дефицитом ме ди и избытком цинка, свинцовой интоксикацией. У пожилых больных не обходимо исключить вторичный характер изменений, в первую очередь - на фоне опухолевого процесса, в частности рака предстательной железы, рака щитовидной железы и др. (объем обследования в таких случаях опре деляется состоянием пациента).
Мегалобластные анемии
Эти заболевания характеризуются изменениями морфологии клеток костного мозга и других быстро делящихся клеток вследствие нарушения синтеза ДНК. Более 90% мегалобластных анемий составляют В12 и фо лиеводефицитные.
Дефицит фолиевой кислоты развивается в течение нескольких меся цев и наиболее часто встречается у лиц, злоупотребляющих алкоголем, больных гемолитическими анемиями, беременных, у людей, принимаю щих противосудорожные препараты или триметоприм/сульфаметокса зол, а также у женщин на фоне приема пероральных контрацептивов.
Дефицит витамина В12 развивается в течение нескольких лет. К нему приводят резекция желудка, кишечный дисбактериоз, воспаление или резекция толстой кишки, кишечные гельминты, гастрит типа А с антите лами против фактора Касла.
Клинические проявления В12 дефицитной анемии: анемический син дром, желтуха, неврологическая симптоматика, глоссит.
Лабораторные данные:
гиперхромная анемия, которая часто сопровождается тромбо и/или лейкопенией, анизопойкилоцитоз; в миелограмме - дисплазия кроветворения; для красного ряда харак
терен мегалобластоз, могут встречаться «кольцевые» формы сидероб

ластов, для гранулоцитопоэза - гигантские метамиелоциты и палоч коядерные нейтрофилы; в биохимическом анализе крови - повышение уровней ЛДГ и били
рубина сыворотки за счет непрямой фракции; спленомегалия;
после начала терапии витамином В12 или фолиевой кислотой в анали зе крови выявляются ретикулоцитарный криз (на 5-7 е сутки) и по вышение показателей красной крови, что нехарактерно для больных рефрактерными анемиями; антитела к фактору Касла;
изменения кариотипа клеток костного мозга при мегалобластных ане миях не встречаются.
Апластическая анемия
Проводится дифференциальный диагноз между апластической ане мией и рефрактерными анемиями, протекающими с аплазией крове творной ткани.
Для обоих патологических состояний характерны панцитопения и связанные с ней инфекционные и геморрагические осложнения, однако при апластической анемии, по данным гистологического исследования, наблюдается более выраженная аплазия кроветворения. При апластиче ской анемии могут встречаться признаки неэффективного эритропоэза, однако в других ростках элементы дисплазии отсутствуют.
Для апластической анемии нехарактерны: изменение кариотипа;
ретикулиновый фиброз (по данным трепанобиопсии);
гепатоспленомегалия (по данным УЗИ).
Диагностическим критерием может служить активность щелочной фосфатазы в нейтрофилах периферической крови, так как у больных рефрактерными анемиями она ниже нормы, а у больных апластической анемией выше нормы.
Пароксизмальная ночная гемоглобинурия (болезнь Маркиафавы-Микели)
Пароксизмальная ночная гемоглобинурия - приобретенная форма гемолитической анемии, обусловленная появлением клона комплемент чувствительных эритроцитов и протекающая с признаками внутрисосу дистого гемолиза, при котором наблюдаются гемоглобинурия, гемоси деринурия, повышение уровня свободного гемоглобина плазмы.
При пароксизмальной ночной гемоглобинурии выявляются:
нормохромная анемия в период кризов (в период ремиссии уровень гемоглобина может быть нормальным);
при больших потерях железа в виде гемосидерина и выраженной ге моглобинурии анемия носит гипохромный характер; ретикулоцитоз;

Обследование и лечение при различных формах миелодиспластических синдромов
в миелограмме - признаки раздражения красного ростка; при гистологическом исследовании - преходящая гипоплазия кост
ного мозга или гиперклеточный костный мозг с гиперплазией крас ного ростка; уровень сывороточного железа нормальный или, при постоянном
внутрисосудистом гемолизе, сниженный. Отличительные признаки:
гипербилирубинемия за счет непрямой фракции; положительные проба Хэма и сахарозная проба, повышение уровня свободного гемоглобина плазмы;
выявление клона эритроцитов CD55– /CD59– , нейтрофилов FLAER+ /CD24+ и моноцитов CD14+ ;
гемосидеринурия, гемоглобинурия в анализе мочи; повышение уровня комплемента;
тромботические осложнения, связанные с внутрисосудистым гемо лизом и стимуляцией факторов свертывания.
Аутоиммунная гемолитическая анемия с синдромом Фишера-Эванса
Может быть проявлением другого заболевания (лимфопролифера тивные заболевания, гемобластозы, системная красная волчанка, хрони ческий активный гепатит, неспецифический язвенный колит, ревмато идный полиартрит) или развиться после перенесенной острой инфекции (грипп, ангина).
При данном заболевании отмечаются анемия, сопровождающаяся тромбоцитопенией и/или лейкопенией, и гиперплазия эритроидного ро стка в миелограмме.
Признаки, свидетельствующие о повышенном гемолизе: гипербилирубинемия; гиперуробилиногенурия; ретикулоцитоз;
антитела к эритроцитам (положительная прямая проба Кумбса) и тромбоцитам указывают на аутоиммунный характер изменений. Спленомегалия не является дифференциальным критерием.
Ответ на глюкокортикоиды свидетельствует об иммунном генезе за болевания.
Острый эритромиелоз (острый эритробластный лейкоз)
Острый эритромиелоз составляет 4-5% от числа первичных острых нелимфобластных лейкозов и 10-20% от вторичных острых нелимфоб ластных лейкозов. Наиболее трудно дифференцировать данный вариант острого лейкоза от РАИБ.
Диагноз устанавливается на основании следующих критериев:
если процент ядросодержащих клеток красного ряда не превышает 50, то процент бластных клеток рассчитывается от общего числа всех ядросодержащих элементов костного мозга;

Миелодиспластические синдромы и апластическая анемия
если процент ядросодержащих клеток красного ряда равен 50 и более и процент миелобластов равен 20 и более; если процент миелобластов менее 20, то их процентное содержание
рассчитывается от числа всех ядросодержащих неэритроидных кле ток и при их доле более 20% устанавливается острый эритромиелоз (тот же диагноз устанавливается, если в периферической крови более 20% бластов, а в костном мозге менее 20%).
Хронический активный гепатит
Клиническая картина представляет собой сочетание астеновегетатив ного, диспептического, лихорадочного, желтушного, абдоминального болевого, суставного и геморрагического синдромов, кожного зуда и эндокринных нарушений.
В гемограмме - анемия, тромбоцитопения, возможна гранулоцито пения.
В миелограмме могут выявляться признаки дизэритропоэза без во влечения других ростков, цитогенетических аномалий нет.
При биохимических исследованиях - изменения метаболизма били рубина и синтетической функции печени, признаки мезенхимально го воспаления, некроза гепатоцитов, холестаза.
Наличие серологических или молекулярных маркеров вирусной ин фекции.
Гепатоспленомегалия, определяемая пальпаторно и/или при УЗИ, КТ брюшной полости.
Может определяться лимфаденопатия.
Для уточнения характера поражения возможно выполнение биопсии печени.
Лимфопролиферативные заболевания
Отличительными признаками лимфопролиферативных заболеваний (волосатоклеточный лейкоз, хронический лимфолейкоз из Т лимфоци тов с крупными гранулами и т. д.) являются:
лимфаденопатия;
моноклональная пролиферация, выявленная при гистологическом и иммунологическом исследованиях биоптата лимфатического узла;
моноклональная пролиферация, выявленная при иммуногистохими ческом исследовании костного мозга и/или при иммунофенотипиро вании лимфоцитов костного мозга или периферичеких лимфоцитов; гепатоспленомегалия.
3. Классификация МДС
В связи с неоднородностью группы МДС диагноз устанавливается на основании данных гемограммы, миелограммы, гистологического и ци тогенетического исследований костного мозга.

Обследование и лечение при различных формах миелодиспластических синдромов
Критерии диагноза МДС по классификации ВОЗ 2000 г. представле ны в табл. 2.
Таблица 2. Критерии диагноза МДС по классификации ВОЗ 2000 г.
Нозологическая форма | Изменения в гемограмме | Изменения в костном мозге |
|
Рефрактерная анемия | Дизэритропоэз. |
||
Бласты - нет или еди | |||
Моноциты < 1 × 109 /л | ного ростков. |
||
< 5% бластных клеток. |
|||
< 15% кольцевых сидеробластов |
|||
Рефрактерная анемия | Дизэритропоэз. |
||
с «кольцевыми» сиде | Бласты - нет | Дисплазия менее чем в 10% клеток |
|
робластами (РАКС) | гранулоцитарного и мегакариоцитар |
||
ного ростков. |
|||
< 5% бластных клеток. |
|||
> 15% кольцевых сидеробластов |
|||
Рефрактерная цитопе | Цитопения. | ||
ния с мультилинейной | Бласты - нет или еди | ||
дисплазией (РЦМД) | < 5% бластных клеток. |
||
Палочки Ауэра - нет. | Палочки Ауэра - нет. |
||
Моноциты < 1 × 109 /л | 15% кольцевых сидеробластов |
||
Рефрактерная цито | Цитопения. | Дисплазия более чем в 10% клеток в |
|
пения с мультили | Бласты - нет или еди | двух и более ростках кроветворения. |
|
нейной дисплазией и | 5% бластных клеток. |
||
«кольцевыми» сиде | Палочки Ауэра - нет. | Палочки Ауэра - нет. |
|
робластами | Моноциты < 1 × 109 /л |
||
> 15% кольцевых сидеробластов |
|||
Рефрактерная анемия | Цитопения. | ||
с избытком бластов 1 | Бласты - нет или еди | стках кроветворения. |
|
Бластные клетки 5-9%. |
|||
Палочки Ауэра - нет. | Палочки Ауэра - нет |
||
Моноциты < 1 × 109 /л | |||
Рефрактерная анемия | Цитопения. | ||
с избытком бластов 2 | Бласты 5-19%. | стках кроветворения. |
|
Палочки Ауэра ±. | Бластные клетки 10-19%. |
||
Моноциты < 1 × 109 /л | Палочки Ауэра ± |
||
Миелодиспластиче | Лейкопения или тромбо | Дисплазия в одном ростке кроветворе |
|
ский синдром не | цитопения. | ния (гранулоцитарном или мегакарио |
|
классифицируемый | Бласты - нет или еди | цитарном). |
|
Бластные клетки < 5%. |
|||
Палочки Ауэра - нет | Палочки Ауэра - нет |
||
5q– синдром | Дизэритропоэз. |
||
Бласты < 5%. | Бластные клетки < 5%. |
||
Тромбоциты - норма | |||
или повышены | |||
Палочки Ауэра - нет. |
|||
Изолированная делеция 5q |
|||
Все вышеперечисленные изменения должны сохраняться в течение не менее 100 дней.

Миелодиспластические синдромы и апластическая анемия
В отечественной литературе варианты МДС с избытком бластов (РА ИБ 1 и РАИБ 2) принято описывать как острый малопроцентный лейкоз.
В случае быстрого увеличения количества бластов диагностируется острый лейкоз и терапия проводится по программам лечения острых лейкозов.
Тот факт, что у больных острыми нелимфобластными лейкозами и рефрактерными анемиями с избытком бластов в трансформации (РА ИБт по классификации FAB) одинаковы течение болезни, ответ на хи миотерапию, частота ремиссий и продолжительность жизни, послужил основанием для пересмотра критериев диагноза острого лейкоза. Диаг ностически значимым принято считать количество бластных клеток в костном мозге, превышающее 20%, и РАИБт в классификации ВОЗ от несена к острым лейкозам.
Хотелось бы остановиться на проблеме хронического миеломоноци тарного лейкоза (ХММЛ), который в классификации FAB рассматри вался как нозологическая форма МДС. В отечественной литературе ХММЛ никогда не классифицировался как вариант МДС. В классифи кации ВОЗ ХММЛ выделен в отдельную нозологическую форму.
Выделяют два варианта ХММЛ:
1. При числе лейкоцитов менее 12 × 10 9 /л и абсолютном моноцитозе в пе риферической крови > 1 × 109 /л и наличии признаков миелодисплазии диагностируют ХММЛ с признаками миелодисплазии (ХММЛ МДС).
2. При числе лейкоцитов более 12 × 10 9 /л и абсолютном моноцитозе в пе риферической крови > 1 × 109 /л диагностируют ХММЛ, протекаю щий как миелопролиферативное заболевание (ХММЛ МПЗ).
ХММЛ разделяют также в зависимости от процента бластных клеток:
ХММЛ I: в периферической крови моноцитоз > 1 × 109 /л и бласты < 5%, в костном мозге бласты < 10%;
ХММЛ II: в периферической крови моноцитоз > 1 × 109 /л и бласты 5-19%, в костном мозге бласты 10-19%.
У больных МДС может выявляться относительный моноцитоз более 10% при абсолютном моноцитозе менее 1 × 109 /л, что позволяет устанав ливать диагноз МДС с моноцитозом.
В 2008 г. ВОЗ была предложена новая классификация МДС (табл. 3). Рефрактерные анемии гетерогенны не только по количеству бласт ных клеток, но и по особенностям гистологической картины костного мозга, на основании которых можно выделить рефрактерные анемии с гипоплазией кроветворения (в случае преобладания жировой ткани над
деятельной), а также с миелофиброзом.
4. Алгоритм терапии больных МДС
При установлении диагноза МДС для выбора терапевтической такти ки необходимы повторное обследование и динамическое наблюдение.
У больных с содержанием бластных клеток в костном мозге более 15% при стабильных показателях гемограммы повторная стернальная пунк

Обследование и лечение при различных формах миелодиспластических синдромов
Таблица 3. Критерии диагноза МДС по классификации ВОЗ 2008 г.
Нозологическая форма | Изменения в гемограмме | Изменения в костном мозге |
Рефрактерная цитопе | Однолинейная | Дисплазия более чем в 10% клеток |
ния с линейной диспла | цитопения: | одного ростка кроветворения. |
< 5% бластных клеток. |
||
Рефрактерная анемия | < 15% кольцевых сидеробластов |
|
Рефрактерная | Нейтропения | |
нейтропения (РН) | ||
Рефрактерная тромбо | Тромбоцитопения | |
цитопения (РТ) | ||
Бласты - нет или < 1%. | ||
Моноциты < 1 × 109 /л | ||
Рефрактерная анемия с | Дизэритропоэз. |
|
«кольцевыми» сидероб | Бласты - нет | Дисплазия менее чем в 10% клеток |
ластами (РАКС) | гранулоцитарного и мегакариоцитар |
|
ного ростков. |
||
< 5% бластных клеток. |
||
> 15% кольцевых сидеробластов |
||
Рефрактерная цитопе | Цитопения. | Дисплазия в 10% клеток и более в |
ния с мультилинейной | Бласты - нет или < 1%. | двух и более ростках кроветворения. |
дисплазией (РЦМД) | Палочки Ауэра - нет. | < 5% бластных клеток. |
Моноциты < 1 × 109 /л | Палочки Ауэра - нет. |
|
Любой процент «кольцевых» |
||
сидеробластов |
||
Рефрактерная анемия с | Цитопения. | Множественная дисплазия во всех |
избытком бластов 1 | Бласты < 5%. | ростках кроветворения. |
(РАИБ 1)а | Палочки Ауэра - нет. | Бластные клетки 5-9%. |
Моноциты < 1 × 109 /л | Палочки Ауэра - нет |
|
Рефрактерная анемия с | Цитопения. | Множественная дисплазия во всех |
избытком бластов 2 | Бласты 5-19%. | ростках кроветворения. |
(РАИБ 2)б | Палочки Ауэра ±. | Бластные клетки 10-19%. |
Моноциты < 1 × 109 /л | Палочки Ауэра ± |
|
Миелодиспластический | Цитопения. | Дисплазия менее чем в 10% клеток |
синдром неклассифи | Бласты ≤ 1%. | одного или более ростков кроветво |
цируемый (МДС Н)в | Палочки Ауэра - нет | |
Бластные клетки < 5%. |
||
Палочки Ауэра - нет |
||
5q– синдром | Дизэритропоэз. |
|
Бласты - нет или < 1%. | Бластные клетки < 5%. |
|
Тромбоциты - норма | Нормальное или увеличенное количе |
|
или повышены | ство одноядерных мегакариоцитов. |
|
Палочки Ауэра - нет. |
||
Изолированная делеция 5q |
а Если в пунктате костного мозга бластов < 5%, в периферической крови бластов 2-4%, то этот вари ант заболевания относится к РАИБ 1.
б Если в пунктате костного мозга бластов < 10%, в периферической крови бластов < 5%, но в бласт ных клетках есть палочки Ауэра, то этот вариант заболевания относится к РАИБ 2.
в Если в пунктате костного мозга бластов < 5%, в периферической крови бластов 1%, то этот вариант заболевания относится к МДС Н.

Миелодиспластические синдромы и апластическая анемия
ция выполняется через 1-2 недели; при повышении процента бластных клеток свыше 20 диагностируют острый лейкоз и терапию проводят по соответствующим программам.
Если в костном мозге при повторном обследовании сохраняется бла стоз менее 20%, соматическое состояние больного стабильно, неблаго приятные изменения кариотипа отсутствуют и цитопенический син дром не требует проведения заместительной гемокомпонентной тера пии, возможна еще одна пункция через 2 недели для оценки темпов раз вития болезни и решения вопроса о начале терапии; если же есть неблаго приятные изменения кариотипа и/или зависимость от гемотрансфузий, то с учетом максимального процента бластных клеток выбирается тера певтическая тактика.
У больных с количеством бластных клеток в костном мозге от 10 до 15% повторную пункцию костного мозга выполняют через 2 недели. Ес ли процент бластных клеток остается неизменным, нет снижения пока зателей периферической крови и зависимости от трансфузий компонен тов крови, то для больных старше 60 лет показано дальнейшее наблюде ние, для больных моложе 60 лет - дополнительное обсуждение возмож ности начала специфической терапии. При прогрессировании цитопени ческого синдрома необходимо решить вопрос о начале лечения с учетом кариотипа.
У больных с количеством бластных клеток в костном мозге от 5 до 9% повторную пункцию костного мозга выполняют через 3-4 недели. Если при повторном исследовании миелограммы процент бластных клеток не превышает 10, нет ухудшения показателей периферической крови и за висимости от гемотрансфузий, то рекомендуется продолжить динамиче ское наблюдение. Если отмечаются повышение процента бластных кле ток в костном мозге, усугубление цитопенического синдрома и зависи мости от гемотрансфузий, то рекомендуется начать специфическую те рапию с учетом особенностей варианта МДС.
Если процент бластных клеток в костном мозге менее 5, то повторное исследование выполняется через 3-6 месяцев или при прогрессирова нии цитопенического синдрома.
Для исследования особенностей костномозгового кроветворения у больных с предполагаемым диагнозом МДС необходимо выполнить би латеральную трепанобиопсию и стернальную пункцию. При последую щих исследованиях костного мозга для пункции желательно выбирать место, где при предыдущем исследовании был получен наибольший про цент бластных клеток. Если при двух или трехкратном исследовании процент бластных клеток варьирует, то диагноз устанавливается на осно вании самого большого значения.
Больной с предполагаемым диагнозом МДС должен быть обследован как минимум дважды, а для принятия оптимального решения по тера пии - трижды.
В процессе динамического наблюдения необходимо оценить прин ципиальную возможность проведения ТКМ, поскольку она может быть выбрана в качестве терапии 1 й линии.

Обследование и лечение при различных формах миелодиспластических синдромов
У пациентов моложе 60-63 лет в первую очередь необходимо провес ти HLA типирование для решения вопроса о возможности проведения аллогенной ТСКК как от родственного, так и от неродственного донора.
Если пациенту невозможно выполнить аллогенную ТСКК, то тера певтическая тактика зависит от клеточности костного мозга и количест ва бластных клеток в миелограмме.
В зарубежных клиниках выбор терапии при МДС зависит от варианта заболевания в соответствии со шкалой IPSS. На наш взгляд, выбор тера пии должен определяться не только выраженностью цитопенического синдрома, процентом бластных клеток в костном мозге и цитогенетиче скими изменениями, но и гистоморфологическими особенностями кро ветворной ткани (табл. 4).
Таблица 4. Тактика терапии больных МДС (ГНЦ)
Клеточность костного мозга
Гипо", гипо/гиперклеточный костный мозг | Нормо/гиперклеточный костный мозг |
||
Бластные клетки, % | Бластные клетки, % |
||
От 5% до < 20% | От 5% до < 20% |
||
Циклоспорин | Циклоспорин | Эритропоэтин | Децитабин. |
(бласты < 10%) | (эЭПО < 500 ед/мл) | Азацитидин |
|
Спленэктомия | FLAG, 7+3а |
||
(бласты < 10%) | (< 30 лет) |
||
Спленэктомия | Децитабин. | Интерферон α | МДЦ - 28 дней |
Азацитидин | (> 50 лет) |
||
Эритропоэтин | МДЦ - 14 дней. | Децитабин. | Меркаптопурин |
(эЭПО < 500 ед/мл) | Меркаптопурин. | Азацитидин | |
Мелфалан | |||
Хелаторная терапия
АТГ - антитимоцитарный глобулин; МДЦ - малые дозы цитарабина.
а Курсы полихимиотерапии FLAG, 7 + 3 с идарубицином.
При фиброзе допустимо назначение преднизолона, даназола.
Критерии ответа на терапию
При проведении какой либо терапии у больных МДС ответ оценива ется по следующим параметрам.
Полная ремиссия - полная нормализация состава костного мозга и периферической крови.
Частичная ремиссия - восстановление показателей перифериче ской крови более чем на 50% от исходных значений, отсутствие за висимости от трансфузий компонентов крови и уменьшение коли чества бластных клеток в миелограмме более чем на 50% от исход ного уровня.

Миелодиспластические синдромы и апластическая анемия
Улучшение - восстановление показателей периферической крови менее чем на 50% от исходных значений и/или уменьшение зависи мости от трансфузий компонентов крови не менее чем на 50%.
Стабилизация - показатели периферической крови прежние, нет уве личения зависимости от трансфузий компонентов крови.Прогрессия - снижение показателей периферической крови и увели чение зависимости от гемотрансфузий; увеличение процента бласт ных клеток по сравнению с исходными значениями, подтвержденное дважды.
Трансформация в острый лейкоз - увеличение количества бластных клеток более 20% в периферической крови и/или костном мозге.
Хелаторная терапия
В настоящее время в России зарегистрированы два препарата для проведения хелаторной терапии:
Деферазирокс (Эксиджад, производитель компания «Новартис») - для приема внутрь.
Дефероксамин (Десферал, производитель компания «Новартис») - для парентерального введения.
Мониторинг феррокинетики (ферритин сыворотки, железо сыворот ки, общая железосвязывающая способность, латентная железосвязываю щая способность, насыщение трансферрина железом) у больных МДС, которым проводится трансфузионная терапия донорскими эритроцита ми, необходимо осуществлять 1 раз в 3 месяца, у остальных пациентов - не реже 1 раза в 6 месяцев.
Хелаторную терапию необходимо проводить пациентам с:
РА, РАКС, РЦМД, 5q– синдромом;
всем пациентам, которым планируется трансплантация костного мозга (!);
если выявляются следующие изменения:
стойкое повышение уровня ферритина свыше 1000-1500 мкг/л, ко торое при трехкратном динамическом определении нарастает и не связано с воспалительным процессом;
повышение насыщения трансферрина железом;
количество трансфузий эритроцитной массы более 20 доз (при стой ком повышении уровня ферритина - независимо от количества транс фузий);
морфологические признаки вторичного гемохроматоза: увеличение количества сидерофагов в костном мозге, отложение гемосидерина в печени и селезенке;
увеличение накопления железа в печени, которое выявляется при магнитно резонансной томографии (МРТ).
При выборе препарата для хелаторной терапии необходимо учиты вать удобство его использования для пациента, эффективность терапии и сочетаемость с другими препаратами, которые принимает больной.
Тип М 0-недифференцированный (низкодифференцированный) миелобластный лейкоз.
Тип М 1. Менее 10% клеток достаточно дифференцированы для появления в их цитоплазме азурофильных (красных) гранул, положительной реакции гранул с миелопероксидазой или суданом чёрным. Большинство клеток имеет крупные округлые ядра, в них видно до четырёх ядрышек.
Тип М 2.Наличие двухлопастных или почкообразных ядер , азурофильных палочек Ауэра, гранул, выявляемых с помощью азура и вышеупомянутых красителей. Часть опухолевых клеток дифференцируется в направлении аномальных промиелоцитов, миелоцитов и даже гранулоцитов.
Тип М 3. Большинство клеточных элементов богато азурофильными гранулами, дающими реакцию с миелопероксидазой. Часть клеток содержит пучки палочек Ауэра и напоминает промиелоциты.
Типы М1–3 - лейкозы миелобластного ряда, каждый из этих типов отличает степень дифференцировки опухолевых клеток.
Тип М 4 имеет две популяции: миелобластов и монобластов. Их можно отличить друг от друга по активности эстераз.
Тип M 5-полное преобладание монобластов в опухолевой популяции.
Тип М 6- наличие миелобластов и примитивных эритробластов с множественными или сегментированными ядрами. Эритробласты могут составлять до 30% всех клеток пунктата, имеющих ядра.
Тип М 7-острый мегакариобластный лейкоз.
Классификация острых миелоидных лейкозов
|
Тип острого миелолейкоза (ОМЛ ) |
Частота ,% |
Морфология |
Особенности |
|
М0, ОМЛ минимально дифференцированный (недифференцированный) |
2–3 |
Бласты с отрицательными маркёрами миелобластов, но с экспрессией антигенов миелоидной дифференцировки |
Относительно редкая форма лейкоза |
|
М1, ОМЛ без созревания клеток |
Преобладают очень незрелые миелобласты, в единичных клетках палочки Ауэра |
Плохой прогноз при наличии Ph-хромосомы (10–15%) |
|
|
М2, ОМЛ с неполным созреванием клеток |
Преобладают миелобласты и промиелоциты, во многих клетках палочки Ауэра |
Хороший прогноз при наличии транслокации t(8;21) |
|
|
М3, острый промиелоцитарный лейкоз |
5–10 |
Гипергранулярные промиелоциты, многочисленные палочки Ауэра, единичные двудольчатые ядра |
Наличие транслокации t(15;17), часто ДВС-синдром |
|
М4, острый миеломоноцитарный лейкоз |
20–30 |
Признаки миело-моноцитарной дифференцировки, миелоидные элементы напоминают М2, в крови моноцитоз |
Прогноз лучше при инверсии хромосомы 16, делеции хромосомы 16q |
|
М5, острый монобластный лейкоз |
Монобласты (пероксидазо-негативные, эстеразо-положительные), промоноциты |
Часто в детском и молодом возрасте, раннее вовлечение дёсен, аномалии в хромосоме 11q23 |
|
|
М6, острый эритролейкоз |
Аномальные эритробласты (мегалобластоиды с гигантскими или множественными ядрами), миелобласты |
Часто у пожилых, инфильтрация органов нехарактерна |
|
|
М7, острый мегакариобластный лейкоз |
Бласты мегакариоцитарного ряда реагируют с тромбоцитспецифическими антителами, миелофиброз |
Редкая форма лейкоза |
Хромосомные аберрации обнаруживают более чем у 80% больных острыми миелолейкозами, самая частая аномалия - трисомия 8. Хромосомные аберрации прогностически значимы. Так, t(8;21) и invl 6 указывают на благоприятный прогноз, t(15;17) и delY - на промежуточный, остальные - на плохой прогноз .
В последние годы активная терапия существенно изменила картину острых лейкозов . Исчезли обширные некрозы в полости рта и зеве, стал менее выраженным геморрагический синдром. Однако в результате увеличения продолжительности жизни больных острым лейкозом возросла частота внекостномозговых поражений (лейкозного пневмонита, лейкозного менингита и др.). Сохранение опухолевых клеток в оболочках мозга возможно, поскольку не все лекарственные препараты проникают через гематоэнцефалический барьер. Терапия цитостатическими средствами увеличила частоту случаев язвенно-некротического поражения желудка и кишечника.